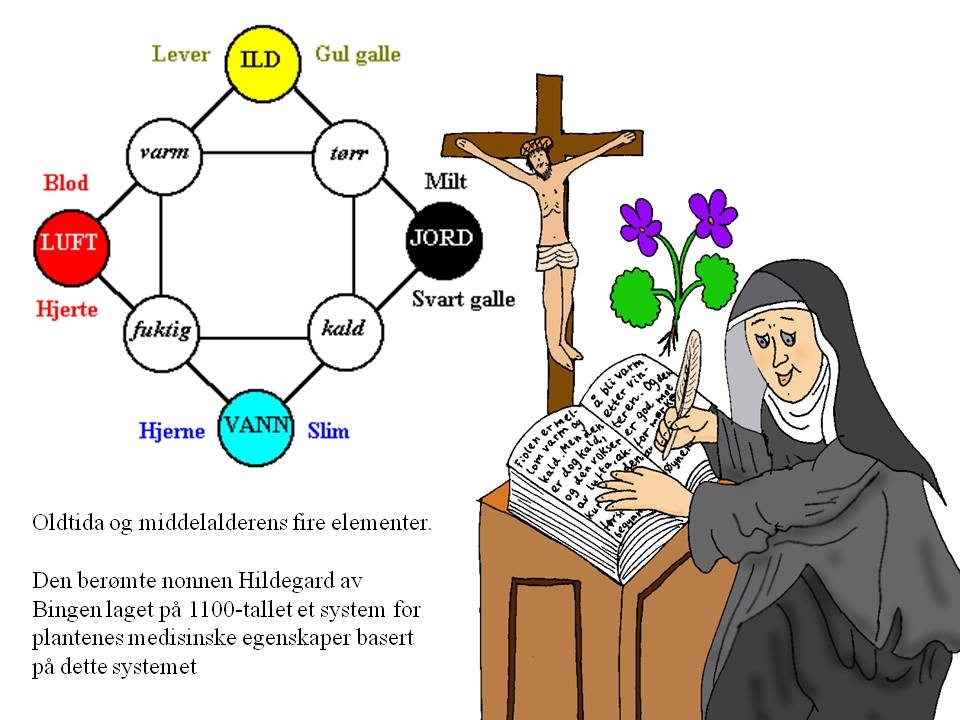
Demokrits geniale tanke vant dessverre ikke innpass i antikken og middelalderens seinere vitenskap. Og den ble raskt avløst av den heller ufruktbare ideen om fire elementer: jord, vann, luft og ild. Disse var karakterisert av følgende tilstander (i samme rekkefølge): tørr/kald, fuktig/kald, fuktig/varm, tørr/varm. Og ikke nok med det, men våre kroppsvæsker, organer og temperamenter fulgte disse fire elementene. Til jord svarte svart galle, milt og melankolsk; til vann svarte slim, hjerne og flegmatisk; til luft svarte blod, hjerte og sangvinsk; og til ild svarte gul galle, lever og kolerisk. I dette tankegodset var det ikke plass til noen atomteori.
Atomteorien vant etter hvert innpass i løpet av 1700-tallet, og kan vel sies noenlunde fullendt ved dansken Niels Bohrs strukturer, som ga ham Nobelprisen i fysikk i 1922.
Som en kuriositet vil jeg nevne at Charles Darwins tyske våpendrager Ernst Haeckel i sitt filosofiske verk "Die Welträtsel" fra 1899 tilla atomene sjel, en slags materiell energi. Sjøl dyktige vitenskapsfolk kan komme med de utroligste villfarelser.
En annen viktig person i elementenes verden er russeren Dmitri Mendelejev som i 1869 laget det beste utkastet til grunnstoffenes periodiske system. Det er dette systemet som i mer eller mindre uforandret form henger på et hvert kjemilaboratorium, og i mange auditorier og gutterom. Riktignok er flere grunnstoffer (til og med mange kunstige) kommet til. På Mendelejevs tid var det mange huller, som nå er fylt ut. Men det geniale ved det periodiske systemet var at man kunne forutsi kjemiske og fysiske egenskaper til grunnstoffene som sto i hullene. Således visste man mye om egenskapene til f.eks. germanium, gallium og scandium før disse ble oppdaget i naturen.
Dette får være nok om atomer og elementer. La oss heller konsentrere oss om den viktigste brikken i livets spill, karbon. Dette essensielle atomet har en kjerne som består av seks protoner og seks, sju eller åtte nøytroner. Har kjernen seks nøytroner får vi isotopen karbon 12, sju nøytroner, karbon 13, og åtte nøytroner, det radioaktive karbon 14 (vanlig brukt ved dateringer av forhistoriske utgravninger). Siden levende vesener foretrekker karbon 12, vil forholdet mellom isotopene 12 og 13 kunne fortelle om karbonet, i for eksempel eldgamle karbonrester fra prekambrium, har biologisk eller ikke-biologisk opphav. Rundt kjernen er det et indre elektronskall med to elektroner og et ytre skall med fire elektroner. Det er denne konfigurasjonen som utgjør karbonets hemmelighet!
Elementet karbon opptrer med tre ansikter: diamant (tredimensjonal krystallstruktur), grafitt (sekskantene ringer i plater som ligger over hverandre) og fullerener, som er kompliserte kuler av ulike størrelser og som minner om fotballer. Fullerener utgjør bestanddel i sot og har stor interesse i nanoteknologi fordi del-strukturene i "fotballen" kan bygge opp nye strukturer.
I det periodiske systemet står karbon midt i andre rad, som begynner med litium og ender med fluor (vi holder edelgassen neon utafor). Nettopp denne plasseringen gir karbonet spesielle egenskaper. Det kan med sine fire ytre elektroner danne fire kovalente bindinger til elementer som hydrogen, oksygen, nitrogen, svovel og halogenene. Karbon har liten evne til å danne ionebindinger nettopp på grunn av sin midtstilte posisjon. Samtidig er det reaktivt nok til også å danne bindinger med seg sjøl. Vi kan få kovalente bindinger i rekker og ringer, og karbon kan danne enkle, doble eller triple bindinger. Akkurat denne egenskapen gjør at karbon er det elementet som danner de fleste, de største og de mest kompliserte molekylene. Ja, fagene organisk kjemi og biokjemi handler til sjuende og sist egentlig om karbonets kjemi.





Logg inn for å kommentere
Ikke UiO- eller Feide-bruker?
Opprett en WebID-bruker for å kommentere