Regel 13 Aromatisk hydrokarbon - aren
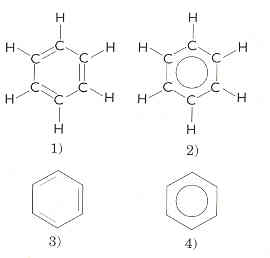
Hos et aromatisk hydrokarbon er antall H-atomer i forhold til C-atomer lavere enn i det alisykliske hydrokarbonet med samme antall C-atomer. Vi skulle da tro at det aromatiske hydrokarbonet i stor grad var umettet og reaktivt, men det er relativt stabilt og har hverken dobbelt- eller trippelbindinger i molekylene. I stedet har et aromatisk hydrokarbon en spesiell type binding mellom C-atomene. Hvert C-atom bidrar med ett elektron til et felleseie i ringen (delokaliserte elektroner), og bindingene mellom C-atomene er tilnærmet likeverdige. De 6 delokaliserte elektronene i benzen (C6H6) blir angitt med en sirkel. Se figur regel 12.
De aromatiske hydrokarbonene kalles med et fellesord for arener. De har gjerne trivialnavn som brukes og må læres, f.eks. benzen. Trivialnavnene ender oftest på -en. Flere ringer kan være bundet sammen og nummereringen av C-atomene i ringene er bestemt av IUPAC.
Eksempel 13
a) C6H6 heter benzen. Strukturformelen blir tegnet på flere måter. Det er alternativ 4) som blir mest brukt.
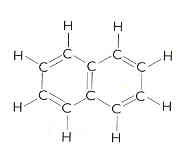
b) Naftalen er et aren. Nummerering av C-atomene i ringene er vist.

c) Antracen er et aren. Den forenklede formelen er

Spørsmål 13
a) Hvor mange C-atomer er det som binder sammen de to benzenringene i naftalen? Hva er molekylformelen til naftalen?
b) Tegn fullstendig strukturformel for antracen. Hva er molekylformelen?
Se fasit
tilbake
Emneord:
skolelab,
kjemi,
skole
Publisert 28. mars 2011 09:44
- Sist endret 19. sep. 2011 09:46



