Transport
Transport gjennom plasmodesmata og membraner
Historie
Runar Collander fant at stoffers gjennomtrengelighet i en membran var avhengig av stoffenes fettløselighet. Et av Collanders forsøk gikk ut på å bruke den svake basen nøytralrødt som er gulfarget i udisssosiert alkalisk form, men blir rødtfarget som kation i sur løsning. Bakegjær oppslemmet i vann som er gjort basisk med 10% natriumkarbonatløsning tilsettes noen dråper nøytralrødt. Fargen skifter fra gul til rød når nøytralrødt tas opp av cellene. At det er cellene som blir røde kan observeres ved filtrering. Tilsettes litt lut (NaOH) er fargen fremdeles rød, men tilsettes ammoniakk skifter fargen tilbake til gul siden ammoniakk kan passere membranen. Collander gjorde studier med Chara-alger som plantemateriale.
Membranpotensial
Plantecellene inneholder flere reaksjonsrom (kompartementer) som det er kommunikasjon imellom. De forskjellige reaksjonsrommene inneholder forskjellig sammensetning av molekyler og ioner. Reaksjonsrommene omgitt av membraner atskiller prosesser som ellers kunne innvirke på hverandre. Biomembranene er bygget opp av et dobbeltlag med lipider med innleirete proteiner og steroider. Proteindelen inne i membranen er hydrofob. Salter og oppløste stoffer omgitt av vannmolekyler skaper et turgortrykk i cellene. Plantecellene er omgitt av en cellevegg og kan omgi seg med rent vann uten å briste. Celleveggene i en celle er kittet sammen med nabocellene med en pektinrik midtlamell. Ved plasmolyse forårsaket av uttørking av cellene eller ved kontakt med sterke saltløsninger (hyperton) vil plasmamembranen delvis bevege seg innover i cellen, men henger fast i celleveggen ved flere kontaktpunkter. Kontaktpunktene til veggen er ved plasmodesmata og ved tynne membrantråder (Hechttråder). Hvilken vei vann vil bevege seg gjennom membraner avhenger av de hydrostatiske trykkforskjellene og av osmotiske trykkforskjeller fra oppløste stoffer over membranen. Membranene er en nødvendig forutsetning for biologisk energiproduksjon. Thylakoidmembranen og den indre mitokondriemembranen bruker en protongradient til å lage ATP. Biomembraner har liten elektrisk ledningsevne, virker som en isolator mellom ledende løsninger, og siden de er selektivt permeable skapes det et membranpotensial. Membranpotensialet oppstår når to væskefaser er atskilt av en membran, og er forskjellen i elektrisk potensial mellom de to vannfasene. Membranpotensialet oppstår når anioner og kationer diffunderer over membranen med ulik permeabilitet slik at det oppstår en ladningsforskjell. Membranpotensialet angir forskjellen i elektrisk ladning mellom innsiden og utsiden av en celle eller kompartement omgitt av en membran. Mikroelektroder som settes inn i en celle viser at cytoplasma inneholder flere negative ladninger enn utsiden og har et potensial fra -20 til -200 mV i forhold til omgivelsene. Fast bundete negative ladninger i celleveggstrukturene gir et Donnanpotensial. De fleste proteiner har negativ ladning ved pH 7.5. Nernstpotensialet framkommet fra Nernstligningen beskriver en likevektsituasjon for et spesielt ion, men membranpotensialet dannes av summen av potensialer for mange forskjellige ioner. Protongradienter har spesielt stor betydning for transport i planter og alle ATPaser gir en elektrogen H+-transport. Aktiv transport av ioner ved hjelp av bærerproteiner som leder til ladningsforskjell kalles en elektrogen pumpe. Aktiv transport krever energi fra respirasjon eller fotosyntese. pH-gradienter over membraner gir et betydlige bidrag til membranpotensialet. De forskjellige celletypene i plantene er avhengige av hverandre. Kompartementene som det skjer transport mellom er:
- 1) Intercellularrom
- 2) Cellevegger
- 3) Cytoplasma
- 4) Vakuoler (mange forskjellige typer).
- 5) Celleorganeller (plastider, mitokondrier, cellekjerner, mikrolegemer (peroksysomer, glyoksysomer).
- 6) Membransystemer (endoplasmatisk retikulum, Golgiapparat)
Gjennom plasmodesmata skjer det kommunikasjon og transport i symplasten fra celle til celle. En plante kan betraktes som en "supercelle" hvor plasmodesmata binder sammen cytoplasma i alle de levende cellene i planten. Det er imidlertid noen steder hvor det ikke er slik kontakt. Dette er mellom:
- 1) lukkeceller og naboceller i kloroplasten.
- 2) maternalt vev og embryo i fruktknuten.
- 3) sporofytt og gametofytt.
Mellom komplekset følgecelle/silrørscelle og omgivende celler kan det i noen tilfeller også være få plasmodesmata (apoplastfylling av silvev) som hos f.eks. poteter (Solanum tuberosum), erter (Pisum sativum), solsikke (Helianthus annuus) og salat (Lactuca sativa). I motsetning til planter hvor fotosynteseproduktene fylles inn i silvevet via plasmodesmata (symplastfylling).
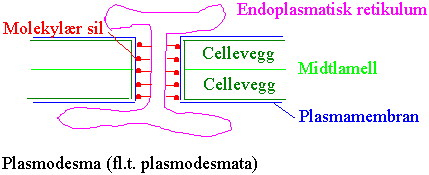
Primære plasmodesmata lages i celledelingen ved at endoplasmatisk retikulum omgis med celleveggmateriale. Sekundære plasmodesmata dannes på seinere utviklingstrinn gjennom allerede eksisterende cellevegger. Plasmodesmata kan ha forskjellig morfologi bl.a. et greinet forløp gjennom celleveggen. Sekundære plasmodesmata må kunne bli dannet når en type plantemateriale podes over på et annet. Molekyltrafikken gjennom plasmodesmata er regulert. Virus som sprer seg systemisk i en plante kan ha bevegelsesproteiner som åpner plasmodesmata slik at viruset slipper igjennom. Ved vinterhvilen hos trær er plasmodesmata stengt. Det finnes også andre eksempler på at plasmodesmata stenges. F.eks. i eldre rothår, og mellom rot og rothette. Skades plantevev blir plasmodesmata stengt i skadeområdet. Et blad som er netto importør av fotosynteseprodukter i tidlig utviklingsstadium har mer åpne plasmodesmata enn når bladet går over til å bli netto eksportør. Studiet av transporten gjennom plasmodesmata gjøre bl.a. ved hjelp av fluorescerende stoffer som tilføres cellene gjennom en glass mikropipette ved hjelp av et kortvarig trykk med nitrogengass eller ved en kortvarig spenningsgradient (iontoforese).
Det er 3 hovedtyper av transportproteiner i membranen, og de er relativt spesifikke for hvilke type forbindelser de transporterer:
1) Kanalproteiner som kan regulere åpning i membranen og hvor det skjer passiv diffusjon. Kanalene åpnes eller lukkes på signaler fra cellen. Åpning av spenningsregulerte kanaler skjer ved endringer i membranpotensialet.
2) Bærerproteiner som danner proteinporer i membranen. Stoffene som fraktes bindes til et sete på bærerproteinet og transportkapasiteten er mindre enn for kanaler.
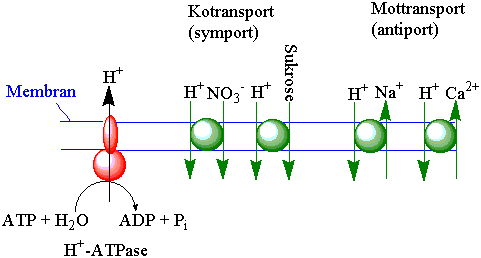
3) Ionepumper som frakter ioner mot en elektrokjemisk gradient ved hjelp av kjemisk energi. Ionepumper kan være ladningsproduserende (elektrogene); eller elektronøytrale som ikke gir noen endring i ladning på de to sidene av membranen. H+-ATPase og Ca2+-ATPase er viktige elektrogene pumper i plantemembraner. H+/K+-ATPase er elektronøytral.
Transportsystemene viser større eller mindre grad av spesifisitet bl.a. ved frakt av D-sukkere og L-aminosyrer. Sure, basiske og nøytrale aminosyrer fraktes av forskjellige systemer. Et protein som transporterer kalium (K+) kan til en viss grad frakte rubidium (Rb+) og cesium (Cs+), selv om de to sistnevnte grunnstoffene ikke er essensielle for planteveksten. Elektrofysiologiske målinger av ionetransport baserer seg på måling av lave strømstyrker (pikoampere), og bruk av glass mikrokapillarer og mikromanipulator.
Ioner beveger seg passivt langs en minskende elektrokjemisk potensialgradient. Marine alger opptak av nitrat og aminosyrer avhengig av natrium (Na+). Transportproteinene ligner på enzymer ved at de har en form for substratspesifisitet, men atskiller seg ved at det ikke skjer noen endring av substratet som fraktes. Transporten følger i mange tilfeller Michaelis- Menten kinetikk. Det kan være forskjellige opptakssystemer tilpasset lave eller høye konsentrasjoner av stoffene som fraktes. Protongradienten som drivkraft for transport av andre stoffer har stor betydning hos planter. Drivkraften påvirkes av konsentrasjonsforskjellen over membranen og membranpotensialet. Membranpotensialet kan angis i kJ per mol eller som millivolt (mV).
Protongradient koblet til transport
Elektrogen H+-ATPase i plasmalemma og tonoplast lager en H+-gradient med energi fra ATP. Den protondrivende kraften kan frakte andre stoffer andre stoffer i samme retning ved symport eller motsatt retning ved antiport. Eksempler på symporttransport er frakt av aminosyrer, sukrose, og anioner som nitrat, fosfat og klorid inn i cellen. H+-sukrose symport finnes i følgeceller, men også i silrørsceller hvor mRNA overføres via plasmodesmata. Natrium (Na+) fraktes ut av cellen ved antiport. Fosforylerte ATP-aser i plasmamembranen kalles P-type ATP-ase. Vanligvis er vakuolene sure i forhold til cytoplasma og protonene kommer fra H+-ATPase. Noen typer blad (hagerabarbra (Rheum x hybridum), syre (Rumex), gjøkesyre (Oxalis)) og frukt (sitron (Citrus limon) og lime (Citrus aurantifolia) kan være svært sure. Den lave pH blir opprettholdt av organiske syrer som malat (eplesyre), oksalsyre og sitronsyre, som også virker som buffere. H+-ATPasene i plasmalemma som kodes av en multigenfamilie er forskjellige fra de i vakuolemembranen (V-type). V-type H+-ATPase ligner mer på dem man finner i kloroplaster og mitokondrier (F-type). Det transporteres enn H+ for hver molekyl MgATP som hydrolyseres. Fosfat midlertidig bundet til aspartyl med en acylfosfatbinding, og fosforylering av enzymet gir lavere affinitet for H+ som derved løsner. Deretter hydrolyseres enzym-fosfatbindingen. H+-ATPase kan aktiveres auxin. Vakuolemembranen inneholder også en H+-PPase (H+-pyrfosfatase) som utnytter energien i pyrofosfat.
Cytoplasma inneholder en lav konsentrasjon av kalsium (Ca2+), i størrelsesorden 0.1 mM, mens konsentrasjonen i celleveggen og vakuolen er høy. Åpning av kalsiumkanaler indusert av inositoltrifosfat gir en midlertidig økning av kalsium i cytoplasma og virker som et metabolsk signal i en signalkjede og gir en midlertidig depolarisering.
"Patch-clamp" teknikk brukes til å studere åpning og lukking av ionekanaler. Vann fraktes over membranen ved hjelp av vannkanalproteiner kalt akvaporiner. Osmotisk potensial (osmotisk potensial) og hydrostatisk trykk (trykkpotensial) bestemmer vannbevegelse
![]()
J er vannfluks, Lp er drivkraften m s-1 MPa-1, s er refleksjonskoeffisienten som er lik 1 for upermeable stoffer og 0 for fritt gjennomtrengelige stoffer. P er hydrotstatisk trykk og pi er osmotisk trykk. Vann kan også til en viss grad passere biomembraner utenfor vannkanalene.
Sopp som gir visnesyke
Noen sopp produserer stoffer som får spalteåpningene i bladene til å stå kontinuerlig åpne slik at planten visner. Et slikt stoff er fusicoccin fra soppen Fusicoccum amygdali som infekterer mandel- og ferskentrær. Fusicoccin aktiverer H+-ATPase i plasmamembranen i lukkecellene og andre celler. Receptoren som binder fusicoccin hører med til signaloverføringsproteiner i 14-3-3 familien, proteindimere som binder seg til andre proteiner.
ABC transportpumper
Disse som har fått navn etter ("ATP-binding casette") frakter organiske stoffer som flavonoider, sekundærmetabolitter, xenobiotika ved hjelp av ATP, men uavhengig av pH- gradienter og elektrokjemisk potensial. ABC transportpumpene er ufølsomme for protonofore som ødelegger pH-gradienten. De har en fosforylert form som hemmes av vanadat på samme måte som P-type H+-ATPase. ABC transportproteiner tilhører en stor gruppe proteiner.
Nernstligningen
Nernstligningen uttrykker ved likevekt sammenhengen mellom elektrisk potensialforskjell over membranen og konsentrasjoner av et ion på begge sider av membranen. Nernstligningen sier noe om et ion fraktes aktivt eller passivt over en membran. Ligningen kan utledes ved å sette det kjemiske potensialet på innsiden av membranen lik potensialet på utsiden. Forskjellen i elektrisk potensial mellom to steder er et mål på elektrisk arbeid som må utføres for å flytte en ladning fra et sted til et annet. Det elektriske potensialet har enheten J mol-1, mens vannpotensial hadde enheten J m-3.
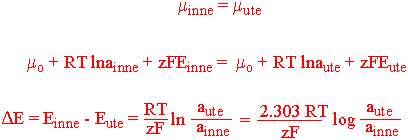
(2.303 RT)/F = 58.2 mV ved 20oC, 59.2 mV ved 25oC og 60.2 mV ved 30oC. Ved 20oC får vi derfor:
![]()
z er positiv for kationer og negativ for anioner. F er Faradays konstant lik 96.500 coulomb per mol. Et Nernstpotensial på 58.2 mV vil kunne opprettholde en konsentrasjonsforskjell på 1:10, f.eks. 1 mM K+ på utsiden og 10 mM K+ på innsiden av plasmamembranen i passiv likevekt. For toverdige ioner vil det tilsvarende potensialet bli 29.1 mV. Nernstpotensialet sammenlignet med det målte membranpotensialet indikerer om et ion er i likevekt over membranen, og om det er aktiv eller passiv transport av et ion over membranen. Imidlertid tar Nernstpotensialet bare for seg ett ion ad gangen. Vanligvis må anioner som nitrat (NO3-), sulfat (SO4-), fosfat (H2PO4-) og klorid (Cl-) tas opp ved aktivt opptak i cellen. Hvordan alle ioner samtidig påvirker potensialet kan beskrives av Goldmanligningen.
Aksjonspotensial
Et aksjonspotensial oppstår når et stimulus gir en midlertidig åpning av en selektiv ionekanal i mebranen slik at det oppstår en fluks av ioner ned deres elektrokjemiske gradient. Derved skjer den en depolarisasjon av membranen i løpet av millisekunder slik at cytoplasma blir mer elektrisk positiv i forhold til de ytre medium før det returnerer til opprinnelig verdi. Sammenklapping av pulvinusceller ved basis av blad og bladstilk hos planten Mimosa pudica følges av et aksjonspotensial.
Størrelser
Plasmamembranen har en tykkelse på 8-10 nm (nanometer). Fettsyrene festet til glycerol har en lengde på ca. 3 nm. Avstanden mellom hydrogen og oksygen i et vannmolekyl er ca. 0.1 nm. Sammenlignet med størrelsen på planteceller fra 10-100 mm (mikrometer) i diameter (1 mm=1000 nm) er plasmamembranen svært tynn. Tykkelsen av celleveggen er ca. 0.5 mm. Bakterier er i størrelsesorden 1 mm, ca. det samme som for mitokondrier og kloroplaster. Sammenlign med bølgelengden for synlig lys fra 400-700 nm.