Orbitaler og atommodeller
J.J. Thomson utviklet i 1897 katodestrålerøret med to elektroder, anode og katode, og en magnet hvor en katodestråle ble fokusert på en glassflate dekket med fosfor. Katodestrålen passerte mellom to elektroder og mellom polene på en magnet, og Thomson viste at katodestrålen bestod av partikler med negativ ladning, elektroner. Det ble også mulig å bestemme massen til elektronet. Rutherfords atomteori fra 1911 betraktet atomet som en positiv kjerne omgitt av elektroner i sirkulære baner. Den danske fysikeren Niels Bohr (1885-1962) laget i 1913 en atommodell hvor elektroner beveger seg i faste baner rundt en atomkjerne. Ifølge Bohrs atommodell hadde elektronene bare bestemte energinivåer omkring kjernen i sine sirkelbaner, og mellomliggende nivåer kunne ikke eksistere. Når et atom absorberte et lyskvant kunne elektronet bevege seg til et annet bestemt energinivå. Modellen var ikke fyldestgjørende og har blitt erstattet av kvantemekaniske modeller, selv om vi benytter oss av begrep som elektronbaner og elektronskall. Elektronet kan på samme måte som lyset betraktes både som både bølge og partikkel. Elektronene befinner seg i en sannsynlighetssky rundt kjernen, dvs. områder rundt kjernen hvor det er størst sannsynlighet for å påtreffe elektroner. Tilstanden til et elektron rundt kjernen kan beskrives av 4 forskjellige kvantetall. Modellen ble videreutviklet med Bohrligningen som inneholdt et heltall n som Bohr kalte kvantetall. Bohrligningen gjorde det mulig å beregne energien til et elektron i en spesiell bane. Det mest stabile energinivået til et atom, grunntilstanden, har et kvantetall n = 1. Når et hydrogenatom absorberer energi vil elektronet bevege seg til en høyere bane, atomet blir eksitert, hvor n = 2 eller høyere. Disse høyere banene er mindre stabile, og elektronet vil gå ned til en lavere bane, og energien som tapes sendes ut som elektromagnetisk stråling. Overgang fra kvantetall n = 2 til n = 1 sender alltid ut en fast energimengde. Eksiterte atomer sender ut helt diskrete bølgelengder med lys. F.eks. vil hydrogen sende ut rødt lys med bølgelengden 656.4 nanometer (nm) med frekvens 4.567 x 1014 Herz (Hz), og energien til ett foton av dette lyset vil være 3.026 x 10-19 Joule (J). Det er spesifikke energinivåer i alle atomer. Hydrogen har bare ett elektron, og lager den enkleste form for atomspektrum, men atomspektret for hydrogen har i tillegg linjer i ultrafiolett og i infrarødt. J.J. Balmer fant i 1885 en ligning som kunne forklare bølgelengden på linjen i den synlige delen av spektret for hydrogen, men en utvidelse av denne resulterte i Rydbergligningen som kunne forklare alle linjene i hydrogenspektret.
Bohrs teori kunne også forklare Rydbergligningen, og Bohr fikk nobelprisen i fysikk i 1922«for hans bidrag i undersøkelsen av strukturen til atomer og strålingen de sender ut». Bohrs atomteori kunne bare forklare hva som skjedde i hydrogen, og dekket ikke hva som skjedde i mer komplekse atomer. Vanskeligheten består at lovene i klassisk fysikk kan ikke brukes på en så liten partikkel som elektronet, som også kan oppføre seg som en bølge, noe som ble foreslått av den franske fysikeren Louis de Broglie som fikk Nobelprisen i fysikk 1929 «for hans oppdagelse av bølgenaturen til elektroner». Akkurat som lysbølgene har bølgelengde og frekvens har materien det samme. Materien kan altså oppføre seg som en bølge. Tunge objekter får en så kort bølgelengde at den blir vanskelig å oppdage. Små partikler har liten masse og lengre bølgelengde.
Broglies ligning:
\(\displaystyle \lambda=\frac{h}{m\nu}\)
hvor h er Plancks konstant, m er massen til partikkelen og v er hastigheten. Små partikler har så liten masse at bølgeegenskapene blir viktige.
Bølger som er i fase øker i intensitet ved interferens. Bølger som er ute av fase opphever hverandre og minsker i intensitet. Fenomenet med forsterking og opphevelse av intensitet kalles diffraksjon. Ser man på en CD-plate kan man observere diffraksjon av lysbølger. Hvitt lys reflekteres av sporene som ligger tett i tett sammen på CD´n og blir oppdelt i mange individuelle lysstråler. Disse lysbølgene utsettes for interferens, hvorav noen forsterkes og noen slukkes. For en bestemt vinkel mellom innkommet og reflektert lys slukkes alle bortsett fra en som vi ser som farget lys. Ved å vende på CD´n ser vi forskjellige farger ettersom vinkelen endrer seg. Det samme prinsippet gir spekter fra et gitter, som er et speil med mange parallelle linjer som ligger tett sammen. Interferensfiltere som bare slipper igjennom lys med bestemte bølgelengder virker etter samme prinsipp.
Oppløsningen til et mikroskop, dvs. evnen til å atskille objekter som ligger tett inntil hverandre er begrenset av bølgelengden til lyset. Elektronene har så korte bølgelengder (0.006 til 0.001 nm) at elektronmikroskopet som benytter seg av en elektronstråle gjør det mulig å observere objekter som det ikke er mulig å se i et lysmikroskop. Bølgeegenskapene til materien gir grunnlaget for bølgemekanikken eller kvantemekanikk som den også kalles. Bølgene har har helt bestemte energinivåer. Fysikeren Erwin Schrödinger (1887-1961) var den første som kunne forklare bølgenaturen til materien med Schrödingerligningene. Elektronbølgen er en stående bølge, og de tredimensjonale bølgeformene kalles orbitaler.I grunntilstanden for et atom har elektronene en bølgeform med lavest mulig energi, og elektronene fyller orbitalene med lavest energi. Den tredimensjonale bølgeformen kan beskrives av 3 kvantetall n, l og m. Orbitalene er sannsynlighetsfordelingen for å kunne treffe på et elektron, atomorbitaler rundt en atomkjerne og molekylorbitaler rundt molekyler, og amplituden til bølgen angir en slik sannsynlighet for å finne et elektron. Det er begrensninger på hvor mange elektroner det kan være i et orbital, og elektronene fylles i orbitalene etter et spesielt mønster avhengig av elektronspinnet. Fordelingen av elektroner i orbitaler kalles elektronkonfigurasjon eller elektronstruktur.
Hovedkvantetallene
Hovedkvantetallene n har verdier fra n til uendelig. . Elektroner i samme elektronskall har samme n. Alle orbitaler som har samme verdi på n sies å være i samme elektronskall. Disse skallene har fått bokstaver K, L, M, O, P, Q... , for henholdsvis n = 1, 2, 3, 4, 5, 6.... Hovedkvantetallene (prinsipalkvantetallene) sier noe om størrelsen og energien til orbitalene (elektronbølgen). For en bestemt verdi av n holder elektronene seg i et spesielt område fra kjernen. For ett hovedkvantetall n kan det være maksimalt n2 orbitaler dvs. 2n2 elektroner.
Sekundærkvantetallene
Sekundærkvantetallene l , også kalt orbitale kvantetall, deler skallene i orbitaler, samt underskall (subskall). Bikvantetallene kan ha verdiene s, p, d, f, g, h (0, 1, 2, 3, 4, 5..., n-1). Elektroner med samme bikvantetall hører med til en gruppe. Denne gruppe må ikke forveksles med gruppe brukt om kolonner i det periodiske systemet. Det kan være maksimalt 2l+1 orbitaler i en gruppe. For atomer med flere elektroner vil man får en rekkefølge med stigende energi: 1s; 2s; 2p; 3s; 3p; 4s; 3d; 4p; 5s; 4d; 5p; 6s; 4f osv. For en gitt verdi av n kan l variere fra l=0 til l= (n-1). Man bruker bokstavkoder s, p, d, ... for å beskrive verdiene av l.
|
0 |
1 |
2 |
3 |
4 |
5 |
..(n-1) |
|
s |
p |
d |
f |
g |
h |
.. |
|
|
|
|
For å vise i hvilket underskall man er oppgir man først hovedkvantetallet etterfulgt av bokstavkoden for underskallet. Hvert skall har et s underskall, og alle bortsett fra det første har et p underskall osv. Hovedkvantetall og fylling av elektronorbitaler.
Magnetiske kvantetall
De magnetiske kvantetallene m deler subskallene i orbitaler avhengig av deres orientering i rommet. Verdiene for m kan variere fra +l til -l. Hvis l = 0 kan m bare ha en verdi: m = 0. Hvis l = 1 kan m ha verdiene +1, 0 og -1. Antallet muligheter for m for s, p, d, og f tilsvarer 1,3,5,7.. osv. Elektroner oppfører seg som små magneter, og dette gir opphav til elektronspin, elektronene kan spinne i en av to mulige retninger omkring sin egen akse. Spinkvantetallet ms kan bare ha to mulige verdier +1/2 og -1/2.
Paulis eksklusjonsprinsipp og Hunds regler
Ifølge den østeriske fysikeren Wolfang Pauli (1900-1958) formulert som Paulis ekskulsjonsprinsipp kan ikke to elektroner i samme atom samtidig ha like verdier for alle fire kvantallene. I et 1s orbital er det bare plass til to elektroner, og disse må ha motsatt spin. Pauli fikk nobelprisen i fysikk i 1945 for denne oppdagelsen. For elektroner som er i par vil dette gi oppheving elektronets magnetiske egenskaper (+1/2 og -1/2 opphever hverandre). I atomer hvor flere elektroner spinner i den ene retningen enn den andre er det et uparet elektron, noe som gir opphav til paramagnetisme. Et paramagnetisk stoff blir trukket mot en magnet. Atomer hvor alle elektronene er i par kalles diamagnetiske. Elektroner som beveger seg gjennom en spole kan lage en elektromagnet.
Elektronkonfigurasjonen for hydrogenatomet med atomnummer Z=1 blir 1s1. Beskrevet i et orbitaldiagram blir dette 1s . Om pilen peker opp eller ned spiller ingen rolle, men når elektronorbitalt er halvfullt tegner vi det med pilen opp. For grunnstoffet Helium (He) med atomnummer Z=2 får elektronkonfigurasjonen 1s2 Osv. blir det for litium (Li): 1s22s1, beryllium (Be): 1s22s2. For karbon (C) med 6 elektroner blir elektronkonfigurasjonen: 1s22s22p2. Det betyr 2 elektroner i p- subskallet, men skal man skrive dette opp i et orbitaldiagram må man bestemme hvor p-elektronene skal plasseres. Plasseringen gjøres ifølge Hunds regel som sier at hvis elektroner plasseres i orbitaler med samme energi, må det gjøres slik at det gir så få parvise elektroner som mulig.
I periode 1 fylles 1s subskallet.
H: 1s1 He: 1s2
I periode 2 fylles 2s og 2p subskallet.
Li:1s22s1 Be: 1s22s2 B:1s22s22p1 C: 1s22s22p2
Nitrogen (N) har elektronkonfigurasjon 1s22s22p3. Og for oksygen (O): 1s22s22p4.
I periode 3 fylles 3s og 3p subskallet. Krom og kobber har en spesiell elektronkonfigurasjon.Elektroner i ytre skall kalles valenselektroner.
Grunnstoffer og kjemiske reaksjoner
De syv første metallene mennesket kjente ble koblet til planetene: gull (Sol סּ), sølv (Måne ), jern (Mars ♂), kvikksølv (Merkur), tinn (Jupiter ), kobber (Venus ♀) og bly (Saturn ħ), jfr. også syv ukedager.
Kjemiske stoffer som ikke kan deles opp i mindre deler kalles grunnstoffer. I et periodisk system er grunnstoffene organisert slik at likheter og forskjeller mellom dem kommer fram. Noen grunnstoffer er gasser ved vanlig temperatur: hydrogen, oksygen, nitrogen, og edelgassene inkludert helium. Vi kjenner til 90 naturlige grunnstoffer og i tillegg kommer 21 grunnstoffer som mennesket har laget. Et kjemisk stoff er satt sammen av to eller flere grunnstoffer i faste masseforhold som danner molekyler. Atomer kombineres ved å dele elektroner mellom seg, noe som gir elektrisk nøytrale molekyler. Hvis atomene kombineres ved elektronoverføring gir dette elektrisk ladete partikler kalt ioner. Vi kan lage en kjemisk formel for et stoff. Rust har kjemisk molekylformel Fe2O3 og består av 2 atomer jern og 3 atomer oksygen. Vann har kjemisk formel H2O, og hvert vannmolekyl inneholder 2 atomer hydrogen og 1 atom oksygen, og kjemisk binding holder atomene sammen. Urea som finnes i urin har kjemisk formel CO(NH2)2 som viser at det er to molekyler amino NH2 bundet til karbon (C), og hvor karbon også er bundet til oksygen (O). Et karbonatom kan binde seg til fire atomer.
I naturen skjer det reaksjoner mellom kjemiske stoffer. Noen ganger er denne reaksjonen dramatisk som når metallet natrium med en skinnende metallisk overflate slippes ned i vann, og det frigis varme, hydrogengass og natriumlut (NaOH) som etser huden. Natrium reagerer meget raskt med oksygen og vann. Eller voldsom reaksjon mellom natrium og klorgass og det dannes natriumklorid (NaCl). Livsfarlig metallisk natrium og klorgass gir livsnødvendig NaCl. Klor (Cl2) er en gulgrønn gass, man kan kjenne lukten hvor små mengder klor dannes ved bruk av Klorin. Klorgass skader lungene. Når en sukkerbit med sukrose løses i vann så endres ikke sukrose kjemisk.
Den tyske kjemikeren Friedrich Wöhler varmet i 1828 opp uorganisk ammoniumcyanat og viste at det ble dannet organisk urea, dette var starten på den organiske kjemien som førte over til biokjemien, kjemien til de levende organismene på Jorden.
Mange krystallinske stoffer inneholder vann, og dette vannet kan fjernes ved å varme opp krystallene. Hydrater inneholder faste mengder vann. Magnesiumsulfat MgSO4·7H2O inneholder 7 molekyler H2O per molekyl MgSO4. Prikken · viser at vannmolekylet ikke er bundet og kan fjernes. Kreftene mellom ioner og vannmolekyler kan være sterk og gjør at ioner kan bestå som faste hydrater f.eks. CuSO4 ·5H2O. Anhydrert vil si uten vann. Dehydrering kan gi fargeendring. Når blåfarget kobbersulfat som inneholder fem molekyler krystallvann CuSO4·5H2O blir varmet opp dannes det hvite krystaller med kobbersulfat CuSO4. En kjemisk ligning viser hva som skjer i en kjemisk reaksjon.
Zink (Zn) reagerer kraftig med svovel (S) i en kjemisk reaksjon og danner zinksulfid (ZnS):
Zn + S → ZnS
Stoffene til venstre for pilen kalles reaktanter og til høyre for pilen produkter.
En kjemisk ligning er balansert hvis det er samme antall grunnstoffatomer på hver sin side av pilene.
Når gassen metan (CH4) brenner fullstendig i reaksjon med oksygen (O2) dannes det karbondioksid (CO2) og vann (H2O) i følgende balansert kjemiske ligning :
CH4 + 2H2O → CO2 + 2H2O
For å angi hvilken fase stoffene befinner seg benytter man (g) = gassfase, (aq) = væskefase og (s) = fastfase.
Når kull (C) brenner med god oksygentilgang (O2) skjer følgende hvor det dannes karbondioksid (CO2):
C(s) + O2 (g) → CO2 (g)
Et grunnstoff har fast atommasse eller atomvekt. Imidlertid har mange grunnstoffer forskjellige atomer med forskjellig masse kalt isotoper. Isotopsammensetningen for et grunnstoff er stort sett lik alle steder på Jorden.
Karbonisotopen karbon-12 (C12,12C) brukes som referanse med 12 enheter masse. Atommassen til et grunnstoff beregnes relativt til et atom karbon-12 (12C). En atommasseenhet er enheten 1/12-del av massen til 12C. En atommasseenhet (1u) kalles en dalton (d). 1u = 1d. Ett atom 12C tilsvarer 12 u.
Fra en blanding av isotoper i et grunnstoff kan man beregne gjennomsnittsmassen. Gunnstoffet hydrogen (H) inneholder 99.985% av isotopen 1H med masse 1.007825u og 0.015% av isotopen 2H med masse 2.01404u. Grunnstoffet klor (Cl) består av 75.77% av isotopen 35Cl og 24.23% 37Cl.
Oppbygningen av atomer
Atomer er satt sammen av subatompariklene protoner, nøytroner og elektroner. Sentrum av atomet består av en kompakt kjerne bestående av protoner og nøytroner. Nøytroner og protoner kalles nukleoner siden de finnes i kjernen.
Symboler for proton, nøytron og elektron er følgende hvor både masse og ladning er angitt:
\(proton \; ^1_1p\)
\(neutron \; ^1_0 n\)
\(elektron \; ^0 _{-1}e \)
|
Partikkel |
Masse (u) |
Masse (gram) |
Elektrisk ladning |
|
Proton |
1.007277252 u |
1.6726430⋅10-24 g |
+1 |
|
Nøytron |
1.008665 u |
1.674954⋅10-24 g |
0 |
|
Elektron |
0.0005485712 u |
9.1093897⋅10-28 g |
-1 |
Masse i atommasseenheter (U) og gram, samt elektrisk ladning til proton, nøytron og elektron.
Elektronene beveger seg rundt kjernen og fyller resten av volumet i atomet. Protonet har en positiv ladning, elektronet har en negativ ladning, og disse tiltrekker hverandre. I et nøytralt atom er det like mange protoner som nøytroner. Nøytronet er nøytralt. I katodestrålerøret i et fjernsynsapparat benytter man seg av en stråle med elektroner styrt av magneter som sendes mot en glassplate med fosforescerende stoff. Massen til et elektron er 9.1093897 10-28 g, og omtrent all massen til et atom er samlet i en kompakt tett kjerne. Diameteren på et atom er ca. 10.000 ganger diameteren til atomkjernen, slik at det meste av volumet til et atom er fylt opp av elektroner. I et grunnstoff har alle atomene samme antall protoner, et antall som kalles atomnummer (Z). Isotoper av et grunnstoff har samme antall protoner, men forskjellig antall nøytroner. Summen av antall protoner og nøytroner kalles massetallet (A).
Massetallet og atomnummeret skrives til venstre for symbolet for grunnstoffet, henholdsvis halvsteg opp og ned.

Støkiometri (gr. stoikheion - grunnstoff; metron - mål) angir forholdet mellom atomer i et stoff.
Et mol av et grunnstoff eller kjemisk forbindelse inneholder Avogadros tall med partikler. Avogadros tall er lik 6.0221367·1023.
Avogadros tall med 12C atomer, det vil se 1 mol, har massen 12 gram. 1 mol med vann (H2O) inneholder Avogadros tall med vannmolekyler. Grunnstoffer har atommasse og molekyler har molekylmasse (formelmasse). Ett mol av et grunnstoff er massen i gram, og er lik grunnstoffets atommasse. Ett mol av et molekylært stoff har massen i gram som er lik molekylvekt (molekylmassen).
Tidligere var definisjonen for et mol antall atomer i 12 gram av karbonisotopen C12 (12C). Et mol er nå 6.02214076·1023. Den 23. oktober er den internasjonale moldagen. Legg merke til at internasjonalt er datoformatet annerledes enn det norske.
\(\displaystyle antall \; mol=\frac{masse}{molekylvekt}\)
Grunnstoffene og periodesystemet
Atomnummeret bestemmer plasseringen i periodesystemet. Periodesystemet ble utviklet av russiske kjemikeren Dmitri Ivanovich Mendeleev (1834-1907) og den tyske fysikeren Julius Lothar Meyer (1830-1895) var pionerene i utvikling av et periodisk system hvor grunnstoffene først ble plassert etter atomvekt, men deretter plassert i en periodisk tabell etter økende atomnummer, som ble stadig mer omfattende ettersom flere grunnstoffer ble oppdaget og beskrevet. Radene, i alt 7, kalles perioder og har økende atommasse. Det er 18 grupper. Grunnstoffenes kjemiske og fysiske egenskaper bestemmes av atomnummeret.
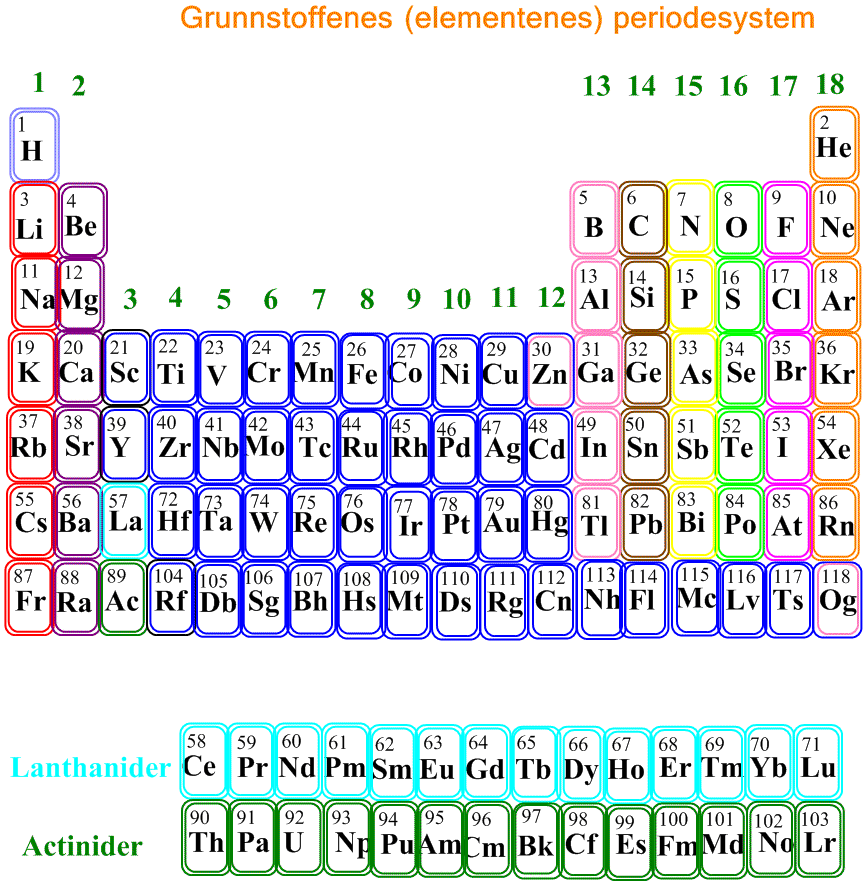
I det periodiske system (periodesystemet) får grunnstoffer som står i vertikale kolonner, grupper, like kjemiske egenskaper. Periodesystemet består til venstre av en blokk med to kolonner (s-blokken) og til høyre en blokk med 6 kolonner (p- blokken), atskilt av en blokk med 10 kolonner (d-blokken).
Under periodesystemet er det en blokk (f-blokken) med to rader, hver bestående av 14 grunnstoffer. Disse 14 er en fortsettelse av lanthan (La) med Z=57 og actinium med Z=89, og plasseres under diagrammet for å spare plass. De kalles henholdsvis lanthanidene og actinidene. Skulle lanthanidene og actinidene skrives inn i samme skjema blir det et system med masse tomrom.
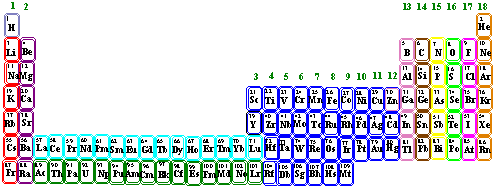
Numreringen av gruppene har variert fra romerske bokstaver til tall. Grunnstoffer som har mange like egenskaper blir samlet i familier eller grupper.
Gruppe 1 alkalimetallene
Alkalimetallene, Gruppe 1 (IA) omfatter hydrogen (H), litium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) og francium (Fr). Disse er, unntatt hydrogen, som navnet sier metaller, og kan danne forbindelser med oksygen som løses i vann og virker alkaliskeHar oksidasjonstall I og finnes som enverdige kationer. Alkalimetallionene er hydratisert og inngår i svake ionebindinger. . Gruppe 1, unntatt hydrogen, mister ett elektron når de reagerer og får ladning +1 eks. kationet av natrium (Na+).
Gruppe 2 alkaliske jordmetaller
Alkaliske jordmetaller (jordalkalimetaller), Gruppe 2 (IIA) (2) omfatter beryllium (Be), magnesium (Mg), kalsium (Ca), strontium (Sr), barium (Ba), og radium (Ra). Beryllium har liten ione- og atomradius og får egenskaper som skiller seg fra de andre i gruppen. Danner oksider og hydroksider, klorider og sulfater Disse er metaller, kan danne forbindelser med oksygen, men mange av disse er ikke løselig i vann og finnes avsatt i berggrunnen. Gruppe 2 mister to elektroner når de reagerer og får ladning +2, og danner toverdige (divalente) kationer.
Gruppe 3-12 overgangsmetaller (transisjonsmetaller)
Gruppe 3 til 12 kalles overgangsmetaller eller overgangsgrunnstoffer (overgangselementer). Flere av transisjonsmetallene kan virke som katalysator.
Gruppe 3 skandiumgruppen med lantanoider og aktinoider
Scandium (Sc), yttrium (Y), lantanoider (lantan (57La)-lutetium(71Lu)) og aktinoider (actinium (89Ac)-lawrencium(103Lr)). Grunnstoffer etter uran (90U) kalles transuraner. De siste grunnstoffene i aktinoidene har meget kort levetid. Scandium, yttrium og lantanoider har vanligvis oksidasjonstall III.
Gruppe 4 titangruppen
Titan (Ti), zirkonium (Zr), hafnium (Hf),og rutherfordium (Rf). Vanligvis i oksidasjonstall IV. Rutherfordium oppkalt etter fysikeren Ernest Rutherford finnes ikke naturlig og er bare laget i laboratorier for kjerneforskning.
Gruppe 5 vanadiumgruppen
Vanadium (V), niob (Nb), tantal (Ta), og dubnium (Db)
Gruppe 6 kromgruppen
Krom (Cr), molybden (Mo), wolfram (W) og seaborgium (Sg)
Gruppe 7 mangangruppen
Mangan (Mn), technetium (teknetium, Tc), rhenium (Re), bohrium (Bh)
Gruppe 8 jerngruppen
Jern (Fe), ruthenium (Ru), osmium (Os), hassium (Hs)
Gruppe 9 koboltgruppen
Kobolt (Co), rhodium (Rh), iridium (Ir), meitherium (Mt)
Gruppe 10 nikkelgruppen
Nikkel (Ni), palladium (Pd), platina (Pt), darmstadtium (Ds)
Gruppe 11 kobbergruppen (myntmetaller)
Kobber (Cu), sølv (Ag), gull (Au), røntgenium(Rg)
Gruppe 12 zinkgruppen
Zink (sink, Zn), kadmium (Cd), kvikksølv (Hg)
Gruppe 13 borgruppen
Bor (B), og metallene aluminium (Al), gallium (Ga), indium (In) og tallium (Tl). mister tre elektroner når de reagerer og får ladning +3 eks. Al3+.Talliumforbindelser er giftige
Gruppe 14 karbongruppen
Gruppe 14 omfatter karbon (C), silisium (kisel, Si), germanium (Ge), tinn (Sn), og bly (Pb)
Gruppe 15 nitrogengruppen
Gruppe 15 omfatter nitrogen (N), fosfor (P), arsen (As), antimon (Sb) og vismut(Bi). Elektronegativiteten minker nedover gruppen med økende atomnummer. Nitrogen (l. nitrum, salpeterdanner) og fosfor (lysbærer) er fundamentale grunnstoffer i alt liv og inngår i gjødsel for planter. Luft inneholder ca. 78 volum% nitrogengass (N2). Nitrat (NO3-) finnes som natriumnitrat ( NaNO3, chilesalpeter) i Atacamaørkenen. Fosfor som apatitt (Ca5(OH,F)(PO4)3). Arsen finnes i arsenikkis (arsenopyritt, FeAsS), og antimon som speilglans (Sb2S3).
Gruppe 16 chalkogener (kalkogener)
Chalkogener (gr. chalkos – kobber, malmdannere) er grunnstoffene i periode 16 i periodesystemet og omfatter oksygen (O), svovel (S), selen (Se), halvmetallet tellur (Te) og og metallet polonium (Po). Ved å ta opp to elektroner danner disse grunnstoffene oksid (O2-), sulfid (S2-), selenid (Se2-) og tellerid (Te2-). Med hydrogen (H) danner de henholdsvis vann (H2O), hydrogensulfid (H2S) og hydrogenselenid (H2Se). Sulfid inngår i pH-likevektene H2S, HS- og S2-, hvor hydrogensulfid er en svak syre (pKa=6.88), Hydrogensulfidionet (HS-) er en meget svak syre (pKa= 14.15) og sulfidionet (S2-) blir en sterk base. Med oksygen danner svovel svoveldioksid (SO2) og svoveltrioksid (SO3). Sulfittionet (SO32-) kan danne svovelsyrling og sulfat (SO42-) kan danne svovelsyre (H2SO4). Svovel kan danne polysulfider. Oksidasjonstall for chalkogener varierer fra –II til VI. Oksygen danner oksider med nitrogen i nitrogenmonoksid (NO) og nitrogendioksid (NO2), og med karbon som karbonmonoksid (CO) og karbondioksid (CO2). Peroksidionet (O22-) danner med hydrogen hydrogenperoksid (H2O2) .
Marie og Pierre Curie isolerte polonium fra bekblende (uranitt, pechblende) som inneholder uran, og ga det navn etter Marie Curies hjemland Polen. Isotopen 210Po er den lengstlevende isotopen.
Gruppe 17 halogener
Gruppe VIIA (17) halogener (saltdannere, gr. halos – salt; genos - avkom) er fluor (F), klor (Cl, gr. kloros - lysegrønn), brom (Br), jod (I) og astat (At) og kan eksistere som molekyler bestående av to like atomer. Av disse er klor (Cl2) og brom (Br2) giftige gasser. Fast jod (I2) kan avgi giftig joddamp. Fluor er det mest elektronegative av alle grunnstoffene i periodesystemet, og elektronegativiteten minsker ettersom man beveger seg nedover i gruppen. Fluorid (F-) inngår i hydroksyapapatitt og som styrker tannemaljen. Organiske fluoroforbindelser er meget resistente mot nedbrytning og skaper flere miljøproblemer. Det samme gjør polyklorerte bifenyler (PCB). Oksidasjonstall –I er vanlig hos alle halogener. Fluor finnes i mineralene apatitt (Ca5(OH, F)(PO4)2 og flusspat (fluoritt, CaF2). Klorid (Cl-) er en viktig anion i planter og dyr. Jodid (I-) inngår i hormonet thyroksin i skjoldbruskkjertelen. Klorid og bromid finnes i saltvann, og jod ble isolert i aske fra alger og fikk navn etter den fiolette fargen. Brom ble isolert fra havsalt. Astat blir dannet i kjernereaksjoner og finnes bare som ustabile isotoper..Jod (I2) er meget tungløselig i vann, men løser seg i blanding med kaliumjodid (KI). En jod-kaliumjodidløsning gir sammen med stivelse en blå farge.
Klorid og hydrogen danner saltsyre (HCl). Med oksygen danner klorid hypokloritt (ClO-, L), kloritt (ClO2-. III), klorat (ClO3-, V) og perklorat (ClO4-, VII) angitt med oksidasjonstall for klor,
Gruppe 18 edelgasser
Lengst til høyre i periodesystemet Gruppe 0 (18) består av edelgassene. De er lite reaktive, men de tyngre av dem kan reagere.Edelgassene helium (He, gr. helios - sol), neon (Ne, gr. neos - ny), argon (Ar, gr. argos - treg), krypton (Kr, gr. kryptos - skjult ), xenon (Xe, gr. xenos - fremmed) og radon (Rn) finnes alle som enatomige gasser i atmosfæren til Jorden. De er reaksjonstrege siden de har ytre stabile og fylte elektronorbitaler. I Universet er helium det nest vanligste grunnstoffet etter hydrogen (H). Helium finnes også i naturgass. Heliumisotopen 4He er den vanligste og dannes ved alfastråling fra ustabile isotoper. Argonisotopen 40Ar blir dannet fra kalium-40 (40K) ved elektroninnfangning. Fra alfastråling av radiumisotoper blir det under naturlige forhold dannet blant annet radonisotopen 222Rn som det finnes mye av i alunskifer og hvor man ønsker at konsentrasjonen skal være lav innendørs, og den radioaktive serien ender med polonium (Po). Radioaktive edelgassisotoper kan bli dannet i kjernereaksjoner. Helium er flytende ved meget lav temperatur (-272.1oC, 1.1K). Edelgassenr unntatt radon har blitt mye brukt i elektriske utladningsrør (neonlamper, xenonlamper etc.). Argon ble brukt i glødelamper for å hindre at wolframtråden (W) fordampet, og glødelampen tålte derved høyere temperatur på wolframtråden.
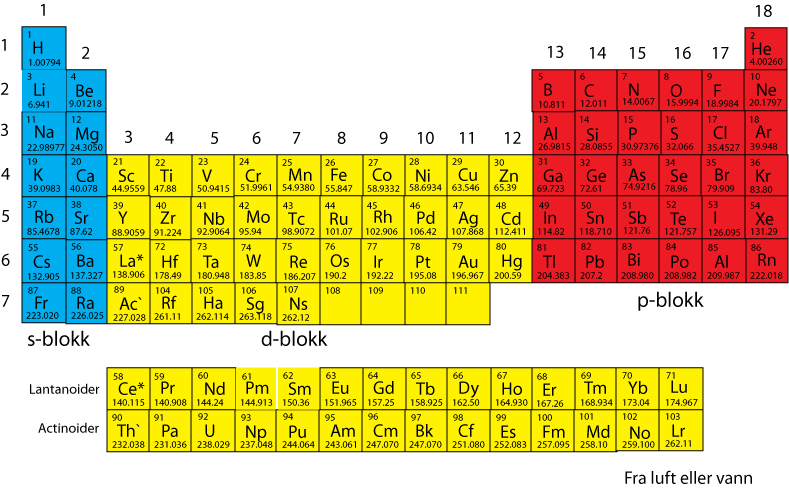
Metaller
Grunnstoffene kan deles inn i metaller (de fleste) og ikke-metaller, men noen kommer i en mellomstilling f.eks silisium og arsen, og disse kalles metalloider. Metallene er skinnende, har metallisk glans, kan lede elektrisk strøm og varme. Metaller føles kalde fordi de leder effektivt vekk varme. Metaller føles kalde fordi de leder effektivt vekk varme. Metallene har varierende evne til å bli valset i plater f.eks. jern (Fe) eller aluminium (Al), eller trukket ut i trådform f.eks. kobber (Cu). Gull (Au) kan valses ut til tynne blader og danne bladgull. Noen metaller er harde som krom (Cr) og jern (Fe), mens kobber og bly (Pb) er relativt bløte, og natrium (Na) blant alkalimetallene kan skjæres med kniv, hvor snittflaten reagerer raskt med oksygen og fuktighet i lufta. Alle metallene unntatt kvikksølv er faste ved romtemperatur. Noen av metallene har høyt smeltepunkt, som wolfram (W) som smelter ved 3400oC, det høyeste smeltepunktet av alle metallene, og brukes derfor som filamentglødetråd i lyspærer (glødelamper). Platina (Pt) og gull er lite reaktive metaller. Metaller kan danne ionebinding med ikke-metaller. Natrium kan avgi et elektron til klor og det dannes saltet natriumklorid (NaCl). Hydrogen (H) i gruppe 1 er et ikke-metall, i motsetning til de andre elementene i gruppe 1. Mange av metallene kalles tungmetaller.
Jern, kobolt og nikkel kalles jernmetallene.
Platina, palladium, ruthenium, rhodium, osmium og iridium kalles platinametallene.

Ikke-metaller
Ikke-metaller er karbon (C), oksygen (O), nitrogen (N), fosfor (P), arsen (As), svovel (S), selen (Se), fluor (F), klor (Cl), brom (Br) og jod (I). Ikke-metallene inngår som oftest i forbindelser med andre stoffer, men ikke nitrogen (N2) og oksygen (O2) som begge er gasser. Det vanligste ikke-metallet er karbon som finnes i alt biologisk materiale, i kull, olje og grafitt eller mer sjeldent som diamant. Ikke-metallene er dårligere ledere av varme og elektrisitet. Mange av dem er i fast fase ved romtemperatur, men noen er gasser. Fluor er f.eks. ekstremt reaktivt, i motsetning til helium (He) som er lite reaktiv.
. Ikke-metallene danner forbindelser med hydrogen og oksygen, og forbindelser med hydrogen kalles hydrider, f.eks. metan (CH4), ammoniakk (NH3), vann (H2O), hydrogensulfid (H2S).
Eksempler på oksider er nitrogenmonoksid (NO), nitrogendioksid (NO2), lystgass (N2O), karbondioksid (CO2), silisiumdioksid (SiO2), svoveldioksid (SO2), SeO2, og As2O3.
Karbon danner sterk binding med andre karbonatomer, og andre grunnstoffer som oksygen, hydrogen og nitrogen.
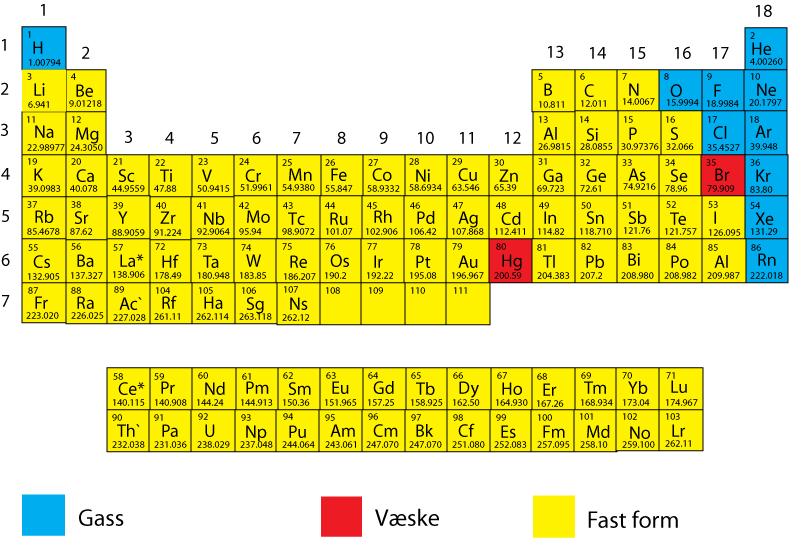
Metalloidene
Metalloidene representerer en overgang mellom metallene og ikke-metallene, og har egenskaper som ligner mest på ikke-metallene, men de kan lede strøm som metallene. Flere av dem er derfor velegnet som halvledere f.eks. silisium (Si) og germanium (Ge). Halvledere er grunnlaget for moderne forbrukerelektronikk og dataindustri. Silisumbrikkene med transistorer er en del av vår hverdag. Man ser tydelig overgangen fra aluminium (Al) som er et metall, til silisium og over til fosfor (P) som er et ikke-metall.
Transisjonsmetaller
Transisjonsmetallene finnes den sentrale delen av periodesystemet fra gruppe 3 - 12, og inneholder bl.a. metallene jern (Fe), krom (Cr), kobber (Cu) og sølv (Ag). Transisjonsmetallene kan finnes i mer enn en form som kation. F.eks. ferrijern (Fe3+) og ferrojern (Fe2+)eller kopro (Cu+) og kopri (Cu2+). En annen betegnelse er etter Stock-systemet: jern(II), jern(III), oppkalt etter den tyske kjemikeren Alfred Stock (1876-1946) som også advarte mot forgiftninger med kvikksølv. Mange av transisjonsmetallene er viktige for overføring av elektroner i biologiske systemer f.eks. mangan (Mn), jern (Fe), molybden (Mo), kobolt (Co), nikkel (Ni), kobber (Cu), og zink (Zn).
Posttransisjonsmetaller
Posttransisjonsmetallene er de metallene som følger umiddelbart til høyre for transisjonsmetallene bl.a. bly (Pb) og tinn (Sn). Lys som absorberes av molekyler, ioner eller atomer eksiterer elektroner fra et lavere energinivå til et høyere. Hvis synlig lys ikke har nok energi til å flytte elektroner fra laveste til høyeste nivå ser stoffet hvitt ut. I transisjonsmetallene er det liten forskjell mellom energinivåene i d-orbitalene og synlig lys, og disse stoffene er ofte farget.
- I periode 1 fylles 1s subskallet
- I periode 2 fylles 2s og 2p subskallet
- I periode 3 fylles 3s og 3p subskallet
Krom og kobber har en spesiell elektronkonfigurasjon.
Når man skal beskrive egenskapene til et atom ser man på fordeling av elektroner i ytre skall (valensskall), siden det er disse som er tilgjengelige for å kunne reagere med andre stoffer. Elektronene i valensskallet kalles valenselektroner. De indre elektronene kalles kjerneelektroner, og har liten betydning ved dannelse av kjemiske bindinger. Hvis man f.eks. ser på alakalimetallene ser man at alle disse har ett elektron i det ytre subskallet s. Dette ytre elektronet kan tapes og etterlater seg en ladning på +1. Elektronkonfigurasjonen som blir igjen er av samme type som for edelgassene.
Den tyske fysikeren Werner Heisenberg viste at det var umulig å bestemme både posisjon og hastighet til en liten partikkel samtidig, kalt Heisenbergs usikkerhetsprinsipp. Sannsynligheten for å finne et elektron i en gitt posisjon bestemmes av amplituden til elektronbølgen, beskrevet kvadratet til bølgefunksjon. Et elektron befinner seg som en elektronsky rundt kjernen (elektronskymodellen). Elektrontettheten sier noe om hvor mye av elektronets ladning som finnes i et gitt volum. I 1s orbitalen er det samme sannsynlighet for å finne et elektron i alle retninger, og sannsynlighetsfordelingen blir en kule, og s orbitalet er kuleformet. I en 2s subskallet er det områder hvor elektrontettheten synker til null. p orbitalet består av 3 orbitaler med lik energi som ligger i rett vinkel på hverandre. I d subskallet er det 5 d orbitaler, hvorav 4 av dem har samme form og består av 4 utvekster, som igjennom ligger i 4 forskjellige plan. Diameteren til et atom er i størrelsesorden 1.4 - 5.7 10-10 m
Enheten Ångstrøm = 1 x 10-10 m, etter den svenske fysikeren Anders Jonas Ångstrøm (1814-1874), er nå erstattet av nanometer = 10-9 meter eller pikometer = 10-12 meter. Både atomradien og ioneradien varierer i periodesystemet. Størrelsen øker fra toppen og nedover i en gruppe, og minsker langs en rad mot høyre. De minste finnes i øverste høyre hjørne av periodesystemet.
Ionisiasjonsenergi er den energien som trengs for å fjerne et elektron fra at gassatom eller fra et ion i grunntilstanden. Grunnstoffene med størst ioniseringsenergi er ikke-metallene øverst til høyre i periodesystemet, motsatt trend av atomradien.
Alle grunnstoffene fra neptunium (atomnummer 93) til transuranene er syntetiske og laget i kjernereaksjoner. Grunnstoffene med atomnummer 93-103 fullfører actiniumserien som starter med thorium-90. De syntetiske grunnstoffene fra atomnummer 104 og utover har meget korte halveringstider og ofte studeres ett og ett atom ad gangen.
Bølger
Bølger på vannet som skapes av vinden er bevegelige bølger hvor vannmolekyler beveger seg opp og ned, mens selve bølgen beveger seg horisontalt med vindretningen. En vibrerende gitarstreng er eksempel på stående bølger. Slår man på strengen vil enden på strengene være fast, mens sentrum vibrerer opp og ned. Noen steder på strengen vil amplituden være lik 0, kalt noder, og mellom disse vil strengen har maksimal amplitude. På en stående bølge vil noder og maksimal amplitude ha sine faste plasser. Notene spilles ved å forkorte strengens lengde ved å presse strengen ned mot gripebrettet. Slår man på strengen og umiddelbart presser ned midt på strengen blir tonen en oktav høyere. De eneste bølgene som kan eksistere er de som halve bølgelengden blir repetert et heltall antall ganger.
\(\displaystyle L=n \left(\frac{\lambda}{2}\right)\)
hvor L er lengden på strengen, λ (lambda) er bølgelengden, og n er et heltall.
Lys som absorberes av molekyler, ioner eller atomer eksiterer elektroner fra et lavere energinivå til et høyere. Hvis synlig lys ikke har nok energi til å flytte elektroner fra laveste til høyeste nivå ser stoffet hvitt ut. I transisjonsmetallene er det liten forskjell mellom energinivåene i d-orbitalene og synlig lys.
Elektrisk ledning
Når elektroner beveger seg i et metall f.eks. kobberledning er det en motstand som hindrer elektronene og denne motstanden gjør at en del av elektronenes energi omformes til varme. For å redusere dette energitapet transporteres strøm over lange avstander med svært høy spenning. På samme måte som mekanisk friksjon hindrer objekter å flytte seg. Hvis metaller eller metallegeringer kjøles ned mot det absolutte nullpunkt blir de superledende. Superledere har ingen motstand mot å lede elektroner. Den nederlandske fysikeren Heike Kamerlingh Onnes fikk nobelprisen i fysikk i 1913 for å ha oppdaget de superledende egenskapene ved kvikksølv ved 4.1K. Nobelprisen «for hans undersøkelser av egenskapene til materien ved lav temperatur, som bl.a. (inter alia) førte til produksjonen av flytende helium». Jfr. Hampson-Linde-prosessen.
En legering med niob og germanium (Nb3Ge) var superledende ved 23.2K. I 1987 fikk K.Alex Müller og J.Georg Bednorz nobelprisen i fysikk «for deres viktige gjennombrudd i oppdagelsen av superledning i keramiske materialer». Oppdagelsen av en supraledende legering bestående av lanthan, barium og kobber (LaBa2CuO4) ved 30 K. Det er seinere blitt laget superledende keramer, men disse er sprø og mister superledningen nær magnetfelter. Det er blitt laget høytemperatur superledere hvor lanthan har blitt erstattet med yttrium (YBa2Cu3O7)
Det har vært omdiskutert om elektriske felter fra høyspentlinjer kan gi fysiologiske effekter. En oscillerende strøm med en frekvens sender ut svak stråling med samme frekvens. Det er på denne måten radio- og TV-stasjoner sender signaler ved å pulse en elektrisk strøm gjennom en senderantenne. Vanlig husholdningsstrøm har frekvens på 50 Herz (Hz) og strømledningene sender ut meget svak elektromagnetisk stråling, så svak at den ikke kan påvirke bindinger i molekyler.