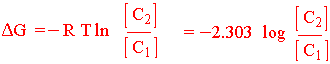
hvor c1 og c2 er konsentrasjonen av oppløste stoffer i to kompartementer (reaksjonsrom) som er atskilt av en semipermeabel membran. Er c2 større enn c1 blir logaritmen til forholdet større enn null dvs. ΔG blir negativ. Hvis det er ioner som beveger seg blir Gibbs fri energi lik:
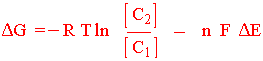
hvor n er ladningen til ionet, F er Faradays konstant og DE er membranpotensialet med samme fortegn som ladningen av ionet.

Gibbs fri energi G (fri entalpi) (Josiah Willard Gibbs) er et mål på tilgjengelig energi i en reaksjon ved konstant trykk og temperatur som kan bli brukt utføre arbeid, for eksempel beregnet via det kjemiske potensialet µ med måleenheten joule per mol (J mol-1). Når man plukker ut en del av verden er det praktisk å bruke et mol (Avogrados tall med partikler). Hvis n er antall mol blir energien per mol G/n. Alle livsprosessene er koblet til forandring i energi.
Det kjemiske potensialet inneholder en referanse µ* og består av komponentene
µ = µ* + RTlna + VP + zFE + mgh
Energien uttrykkes alltid I forhold til en referanse µ*
1. Oppløste stoffer (RTln a) hvor ln er naturlig logaritme med grunn e, R er den universelle gasskonstanten (8.314 mol-1 K-1)), T er absolutt temperatur og a er aktiviteten. Aktiviteten a er koblet sammen med konsentrasjonen c via en aktivitetskoeffisient γ (Debye-Hückel teori), a = γc. Det er denne energien som utnyttes i et osmosekraftverk, hvor rent vann utfører arbeid når vannet passerer over en semipermeabel membran og inn i en saltløsning.
2. Trykk(P)-volum (V), V·P. Trykk kan utføre arbeid. Temperaturen påvirker Gibbs energi for en ideell gass (Gibbs-Helmholtz ligning)
µ = µ* + kT ln p/po
3. Elektrisk ladning zFE hvor z er antall ladninger, 1 for enverdige, 2 for toverdige osv.. For et elektron blir z=-1. F er Faradays konstant, ladningen til ett mol protoner (96490 coulomb mol-1= 96490 J mol-1 V-1), og E er elektrisk potensial. Det ligger mye potensiell energi i ladningsforskjeller. Kjemisk energi kan bli omdannet til elektrisk energi.
4. Høyde mgh, hvor m er massen, g er gravitasjonskonstanten og h er høyden. Denne energien blir brukt i en vannkraftverk
Hvis ΔG er negativ vil det si at reaksjonen kan skje med frigivelse av energi, en eksergonisk reaksjon. For spontane prosesser minsker Gibbs energi ved konstant trykk og temperatur, og minskningen er lik maksimal mengde energi som er tilgjengelig for å utføre arbeid. Selv om reaksjonen er eksergonisk betyr ikke nødvendigvis at den skjer raskt. Diamant blir omdannet til grafitt i en eksergonisk reaksjon, men den skjer meget sakte. Den motsatte reaksjonen hvor grafitt blir omdannet til diamant krever høyt trykk og temperatur.
Hvis ΔG er positiv må det tilføres energi for å få en reaksjon i systemet, en endergonisk reaksjon.
Gibbs energi kan uttrykkes på forskjellig måte:
G = U + PV –TS
G = H - TS
hvor U er indre energi (joule, J), P er trykk (pascal, Pa), V er volum (m3), T er absolutt temperatur (Kelvin, K), S er entropi (J/K) og H er entalpi (J).
En pascal vil si en newton per kvadratmeter. 1 Pa = 1 N m-2 = 1J m-3 = 1 kg m-1 s-2.
En måte å uttrykke Gibbs energi er:
ΔG = -RTlnK
hvor K er likevektskonstanten., og R er den universelle gasskonstanten.
Elektrontransport er fundamentalt for alt liv og endringen i elektrisk energi ved å flytt ett mol elektroner er –nFΔE, og uttrykt som endring i Gibbs fri energi
ΔG = -nFΔE
Gibbs energi er proporsjonalt med forskjellen i elektrisk potensial ΔE. Hvis elektroner forflytter seg mot mer positivt elektrisk potensial hvor ΔE er større enn null (ΔE > 0), så blir ΔG negativ og det blir frigitt energi. Det er dette som skjer når elektroner faller nedover en redoksskala i fotosyntesens elektrontransport fra et mer negativt redokpotensial til et mer positivt redokspotensial. På den annen side, når ΔE < 0, så blir ΔG positiv og det må tilføres energi for at reaksjonen skal skje, dvs. i fotosyntesen trengs det lysenergi for å flytte elektroner fra redokspotensialet til vann til redokspotensialet for eksitert reaksjonssenterklorofyll.