Bjerrumdiagrammet gjelder for både monoprote (1), diprote (2), triprote (3) og tetraprote (4) syrer, hvor tallet i parentes angir antall protoner (H+) i syren. En buffer er en oppløsning med et syre-basepar for en svak syre. Et buffersystem kan tilføres sterk syre eller base uten at det gir store endringer i pH. Et buffersystem har størst bufferkapapsitet rundt pKa-verdien.
Bjerrumdigram for CO2 i sjøvann
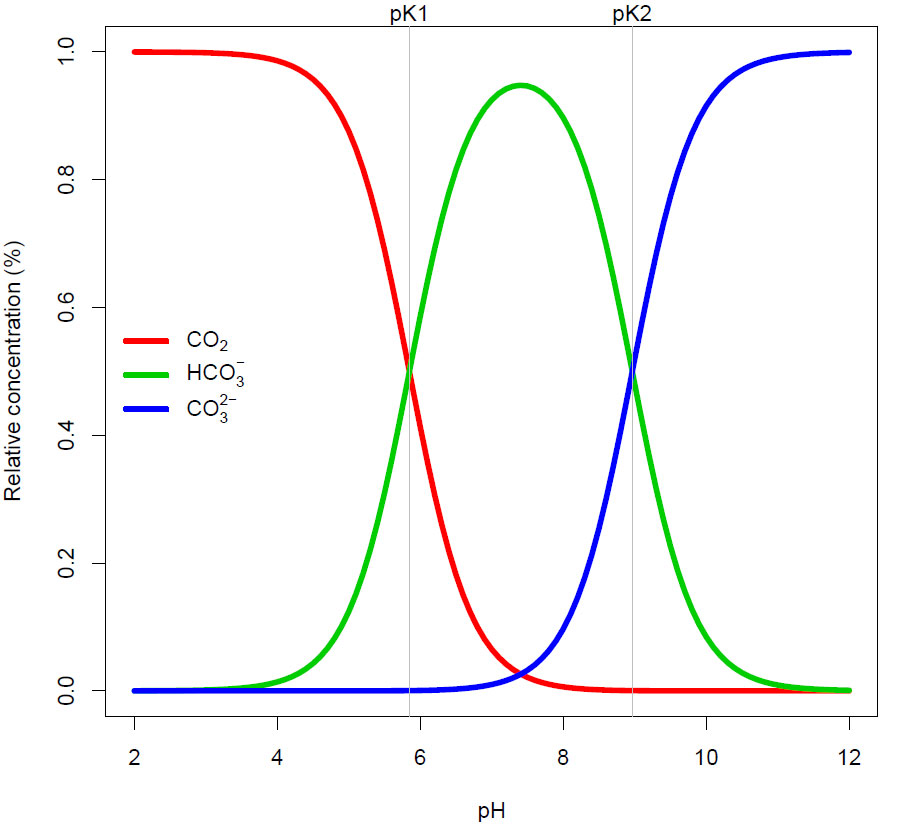
Bjerrumdiagram for karbon i formene karbondioksid (CO2), hydrogenkarbonat (HCO3-) og karbonat (CO32-) i sjøvann som funksjon av pH. Det er flere faktorer som påvirker løsning av gasser i en væske. e.g. saltinnhold (salinitet), temperatur, aragonitt, kalsitt. Ved pK-verdien er det like mye av de to formene, her pK1=5.85 og pK2=9.0. e.g. i ferskvann pK1=6.3, pK2=10.3 Fra pakken seacarb i R. Ved pH=8 i sjøvann foreligger ifølge Bjerrumdiagrammet over ca. 90% av uorganisk karbon oppløst som HCO3-, ca. 9% CO32-, ca. 1% CO2, og H2CO3 ca. 0.001%. Kalsiumkarbonat kan være i formene kalsitt eller aragonitt og er det største lageret for CO2 i verdenshavene.
Reaksjonen mellom karbondioksid (CO2) og vann (H2O). (H+ er egentlig hydroniumionet H3O+).
CO2 + H2O ⇔ H2CO3 ⇔ H+ + HCO3-
som delreaksjoner med likevektskonstant K1 for:
CO2 + H2O ⇔ H+ + HCO3-
og med likevektskonstanten K2for delreaksjonen
HCO3- ⇔ H+ + CO32-
H+ er protoner og foreligger i vann som hydrioniumioner H3O+. Ved lav pH er CO2 i den dominernde formen, og ved høy pH e.g. i sjøvann er det bikarbonat (hydrogenkarbonat) ( HCO3-), og karbonat (CO3-) som er de dominernde former. I nærvær av kalsium blir karbonat utfelt som kalsiumkarbonat (CaCO3). Mengen karbonsyre (H2CO3) er liten i forhold til de andre formene og utelates ofte i Bjerrumdiagrammet.
Løselighet av gasser i væsker avhenger av Henrys lov av fire faktorer: 1. Partialtrykket til gassen, og løseligheten øker med økende partialtrykk 2. Temperaturen til løsningsmiddelet. Løseligheten minsker med økende temperatur 3. Hvor mye salt det er i løsningen. Løseligheten minsker med økende saltinnhold 4. Absorbsjonskoeffisienten til gassen.
Bjerrumdigram fosfat i sjøvann

Bjerrumdigram for de forskjellige formene av fosfor: fosforsyre (H3PO4), dihydrogenfosfat (H2PO4-), hydrogenfosfat (HPO42-) og fosfat (PO43-) som funksjon av pH i sjøvann. Fra pakken seacarb i R. Her er pK1=1.6 , pK2= 6.0 pK3= 8.8. I ferskvann e.g. pK1=2.15, pK2=7.20, pK3=12.33 , men påvirkes av temperatur og salinitet.
Bjerrumdiagram CO2 i ferskvann
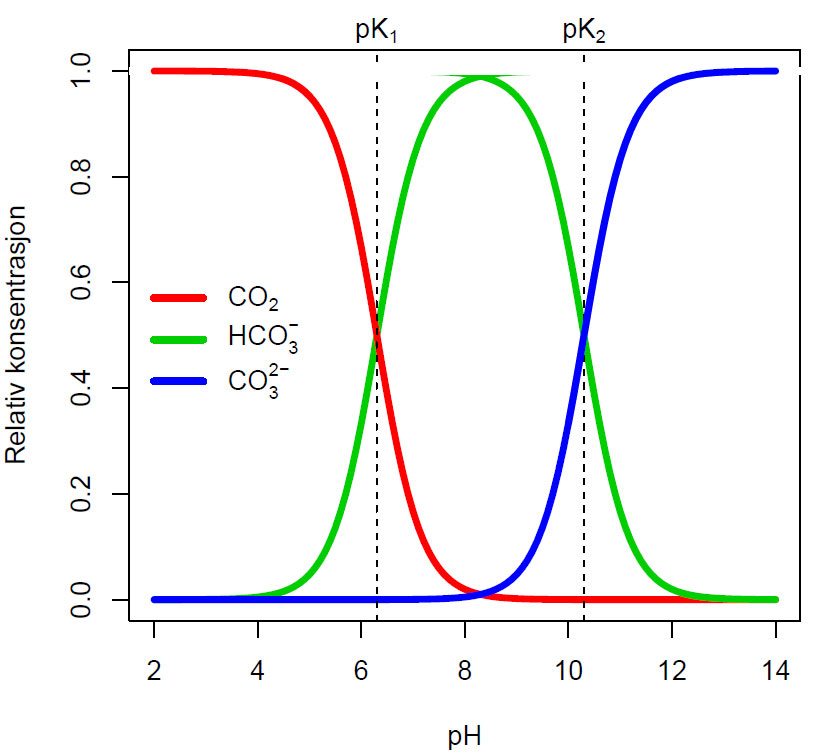
Bjerrumdiagram for CO2 med pK1= 6.3 og pK2= 10.3. Relative konsentrasjoner (syrebrøk) på y-aksen.
Bjerrumdiagram ammonium-ammoniakk
Det er pH-likevekt mellom ammonium (NH4+) og ammoniakk (NH3). Ammoniakk (NH3) er en illeluktene giftig gass, og ammonium (NH4+) er giftig for dyr og mange planter (ammoniumtoksisitet).
\(NH_4 ^+ \;\; \iff\; NH_3 + H^+\)
Apparent likevektskonstant Ka: (a-acid, s-syre), denne angis også som Ks):
\(K_a= \displaystyle\frac {[NH_3][H^+] }{[NH_4^+]}\)
\(pH= \displaystyle pK_a - \log \frac{[NH_4^+]}{[NH_3]}\)
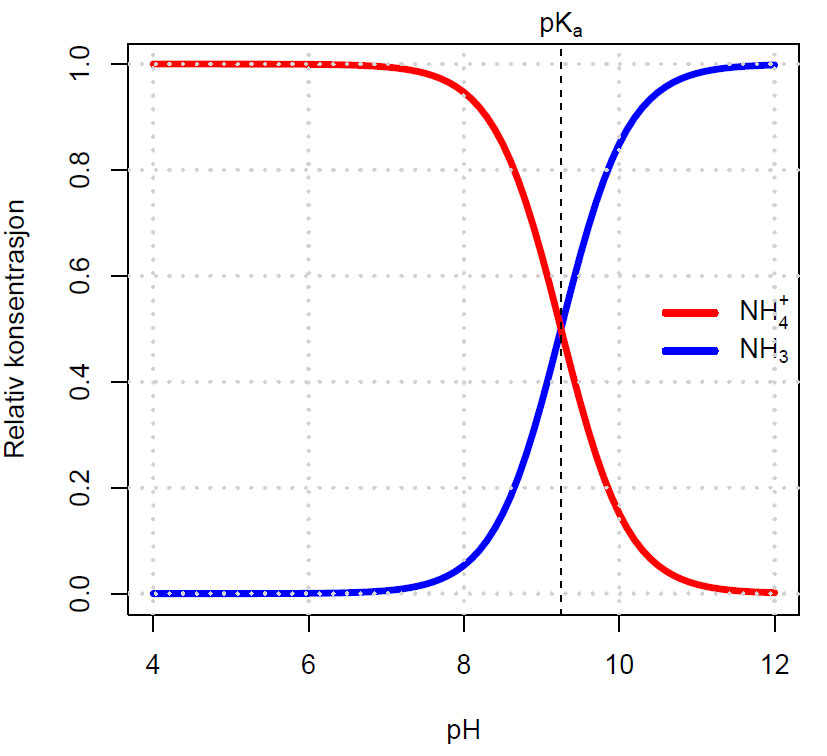
Bjerrumdiagram for pH-avhengig likevekt mellom ammonium (NH4+) og ammoniakk (NH3). Fra figuren ser vi at når pH>7 så øker andelen med flyktig ammoniakk. pH ved pKa-verdi= 9.25 så er det like mengder med ammonium og ammoniakk (log101=0).
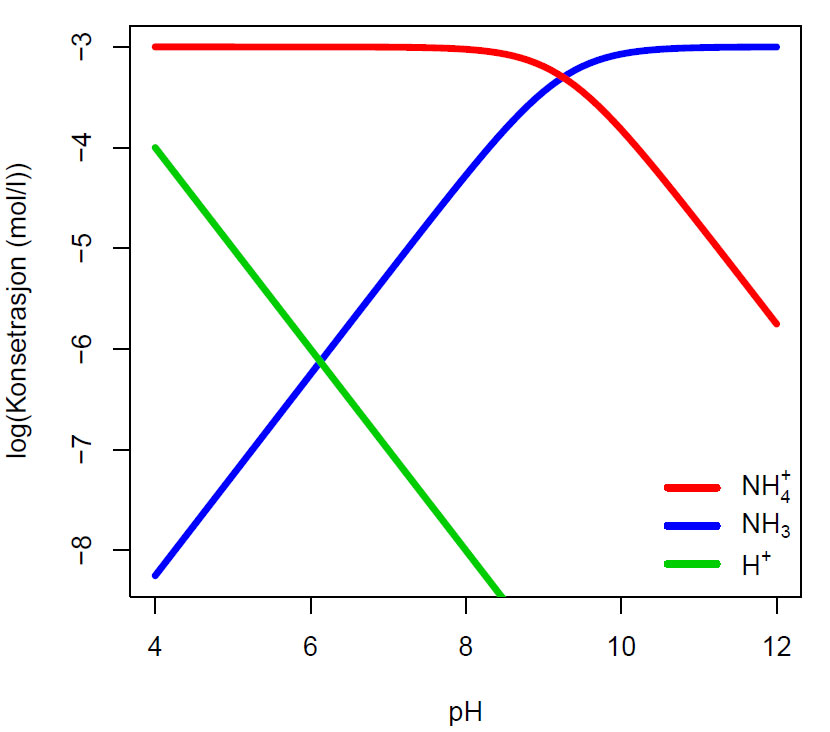
Bjerrumdiagram for likevekt ammonium (NH4+) og ammoniakk (NH3) løst i vann med totalkonsentrasjon 0.001 M (log10(0.001)= -3) (1mM N). Når pH stiger så synker konsentrasjonen av protoner (H+). pH= -log[H+], og vi ser e.g. at ved pH=4 er konsentrasjonen av H+= 0.0001 M (log10(0.0001)= -4). Ved ca. pH=6 er det like mange positive negative og positive ladninger og dette blir også den teoretiske pH-verdien i løsningen.
Bjerrumdiagram for eddiksyre-acetat
Bjerrumdaigram for pH-likevekt mellom eddiksyre (etansyre) og saltet acetat (etanoation). Ved lav pH er eddiksyre udissosiert. Ved pH 4.76 hvor pH er lik pKa så er halvparten (50%) i sur form (CH3COOH) og den andre halvparten på baseform (CH3COO-) Ved høy pH (basisk) synker mengden av syreformen til null.
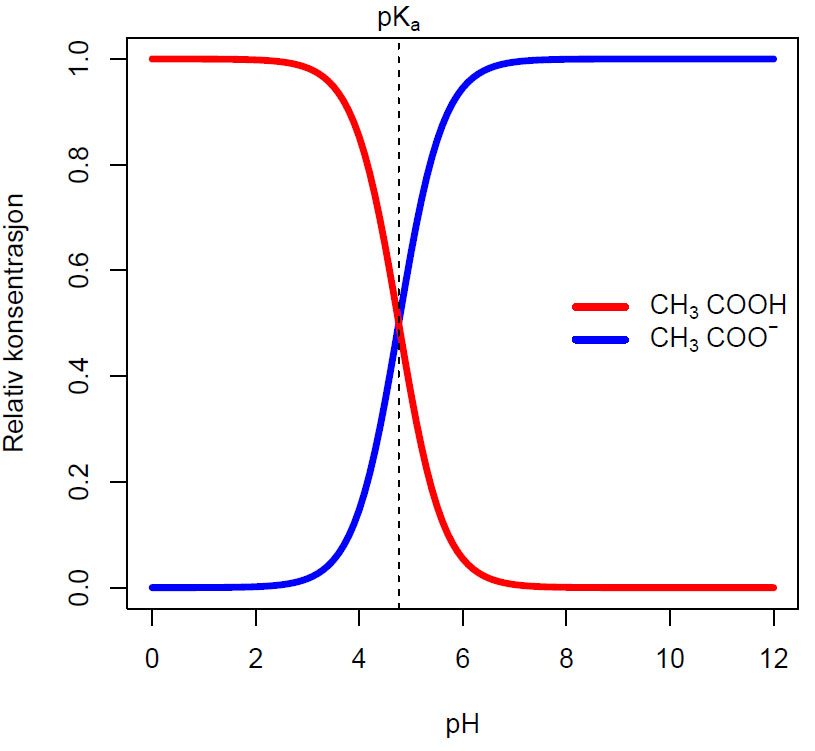
Bjerrumdiagram for likevekten mellom eddiksyre (CH3COOH) og acetat (CH3COO-)
Bjerrumdiagram for hydrogensulfid (H2S)
Hydrogensulfid er en både nødvendig gass i metabolismen, men også giftig i høye konsentrasjoner,.
Hydrogensulfid er flyktig, men løser seg i vann. Det innstiller seg en likevekt mellom gassfase og væskefase, og en pH-avhengig likevekt mellom dihydrogensulfid (H2S), hydrogensulfid (HS-) og sulfid (S2-)
H2S(g) ↔H2S(aq) ↔HS- + H+↔ S2- + 2H+
Her pKa1= 7.05 og pKa2= 12.9, men disse kan variere under forskjellige betingelser.
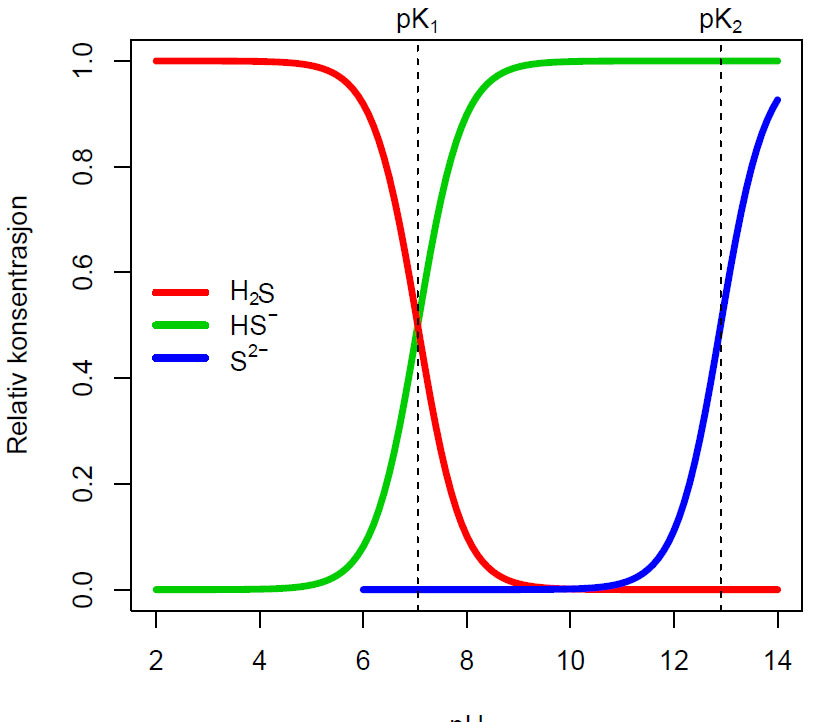
Bjerrumdiagram for hydrogensulfid. Ved fysiologisk pH 4-8 foreligger den som H2S i likevekt med HS-. H2S er flyktig og størst mengde i surt miljø.
Bjerrumdiagram teori
Vi har følgende syre-basereaksjon hvor BH er syre og H+-donor, B- er den konjugerte base, H+ er hydrogenion, K er likevektskonstant. Svake syrer blir ikke fullstendig dissosiert i vann. I første omgang har vi utelatt vann i reaksjonen.
\(BH\; \leftrightarrow\; H^+ + B^-\)
\(K=\displaystyle\frac{\left[H^+ \right] \cdot \left[B^- \right]}{\left[ BH\right] }\)
Totalmengde base BT:
\(B_T= [BH] + [B^-]\)
Kombinerer disse:
\([BH]= \displaystyle\frac{B_T \cdot [H^+]}{K + [H^+]}\)
\([B^-]= \displaystyle\frac {B_T \cdot K}{K + [H^+]}\)
Definisjon av pH:
\(pH= -\log [H^+] \;\;\;\;\;\; \implies [H^+]= 10^{-pH}\)
\(pK = -\log[K]\)
Vi bruker logaritmefunksjonen (Briggske logaritmer med grunntall 10) på begge sider av likhetstegnet i ligningene over og får:
\(\log [BH]= \log B_T \cdot \log[H^+]- \log (K + [H^+])\)
\(\log [B^-]= \log B_T + \log K - \log(K + [H^+])\)
Hvis pH > pK er det mest base. Hvis pH <- pK er det mest syre, og hvis pH=pK er det like mengder syre og base. pH i løsningen er ved elektronøytralitet det vil si [B-]= [H+]
Bjerrumdigram CO2-likevekter
Karbondioksid i luft CO2(g) med partialtrykk pCO2 løser seg i vann CO2(aq).
\(CO_2(g) ^{\;\;K_0 } _{\iff } \; CO_2 (aq)\)
Gassløselighet i væske skjer ifølge Henrys lov, men CO2 følger ikke ikke helt loven siden man i tillegg har følgende to likevektsreaksjoner
\(CO_2 + H_2O ^ \;\;\; ^{\;\;K_1}_ { \iff}\;\; HCO_3^- + H^+ \;^{\;\;K_2}_ { \iff}\;\; CO_3 ^{2-}+ 2H^+\)
\(\text{Total mengde oppløst karbon (DIC)}= \sum [CO_2]+ [HCO_3 ^-] + [CO_3 ^ {2-}]\)
Fotosyntese i neddykkete vannplanter, alger og fytoplankton minsker DIC ("dissolved inorganic carbon") , mens cellerespirasjon i organismer i vannet økder DIC. Imidlertid tar fotosyntetiserende organismer opp nitrat (NO3-) som vil påvirke pH i vannet.
\(\text{Alkalinitet}= [HCO_3^-] + [2CO_3^{2-}]\)
Likevektsreaksjoner:
\(K_ 1=\displaystyle\frac{ [HCO_3^-][H^+]}{ [CO_2]}\)
\(K_2 = \displaystyle\frac{[CO_3 ^{2-} ][H^+]}{[HCO_3^-]}\)
Litteratur
R Core Team (2019). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/.
Wikipedia