NADPH/NADP+ er eksempel på et redokspar i fotosyntesens elektrontransport og i oksidativ pentosefosfatvei, mens NADH/NAD+ er et eksempel fra glykolysen og sitronsyresyklus, hvor disse kan inngå videre i elektrontransprotkjeden i mitokondriene og danne ATP. Alt liv på Jorden skaffer seg energi via trinn i redoksskalaen.
Oksidasjonsreaksjoner og reduksjonsreaksjoner forekommer vanlig i både planter og jord. Kjemiske reaksjoner hvor elektroner overføres kalles redoksreaksjoner. Ofte er det oppgitt redokspotensialet ΔE som er potensialforskjellen i millivolt (m)V mellom en platina elektrode og en standard hydrogen elektrode evt. kalomelelektrode. I et redoksparhar vi to typer av halvreaksjonen, hvor n -er antallet elektroner (e-):
Xoks (oksidert form) + ne- ⇔ Xred (redusert form)
Yred (redusert form) ⇔ Yoks (oksidert form) + ne-
De oksiderte og reduserte formene av Xoks/Xred og Yoks/Yred kalles redokspar. Siden
elektronene ikke forekommer fritt i løsning må et redoksystem kobles til et annet.
Halvreaksjonene blir tilsammen:
Xoks + Yred ⇔ Xred + Yoks
Elektroner beveger seg spontant mot høyere elektrisk potensial.
Elektrondonor = reduktant = reduksjonsmiddel = mer negative redokspotensial
Elektronmottaker = oksidant = oksidasjonsmiddel = mer positive redokspotensial
Inngår protoner (H+) i reaksjonen:
Xoks (oksidert form) + ne- + mH+⇔ Xred Hm(redusert form)
n kan være lik eller forskjellig fra m.
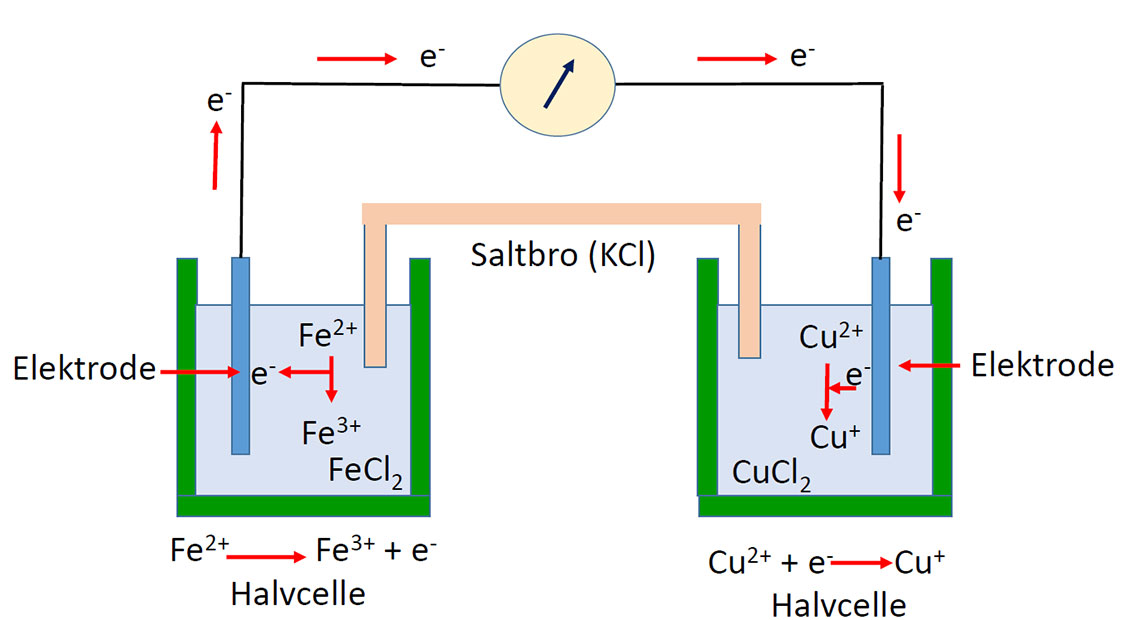
To konjugerte redokspar (( l. conjugatus – binde sammen) koblet sammen med en saltbro vil det gå elektroner (e-) fra en elektrondonor til en elektronakseptor. I hvilken grad dette skjer avhenger av hvor mye elektronakseptoren trekker på elektroner.
Redokspotensialet sier noe om evnen til å motta eller avgi elektroner for et redokspar. Et redokspar med mer negativt potensial vil avgi elektroner til et redokspar med mer positivt potensial. Elektroner tiltrekkes av positive potensialer.
Jo større forholdet redusert/oksidert er desto mer negativt er redokspotensialet. Ved lik mengde oksidert og redusert form har vi midtpunktsredokspotensialet. Det er dette vi angir i volt og er et mål på relativ evne for et redokspar til å avgi eller motta elektroner fra et annet redokspar.
Redoksreaksjoner kan produsere elektrisk arbeid i en elektrokjemisk celle. En elektrondonerende reaktant kalles reduktant (reduserende substans), en elektronmottakende reaktant kalles oksidant (oksiderende substans). Evnen et redokssystem har til å utføre arbeid avhenger av konsentrasjonsforhold mellom reduktant og oksidant og potensialforskjellen mellom de to halvcellene.
\(\displaystyle \Delta E= \Delta E^o + \frac{RT}{nF} \ln \frac{[\text {elektronaksepto}r]}{[\text{elektrondonor}]}= \Delta E^o + \frac{RT}{nF} \ln \frac{a_{oks}}{a_{red}}\)
Som redokspotensial i biologi angi vanligvis midtpunktsredokspotensialet ved pH 7 , hvor det er like mengder av den reduserte og oksidere formen i redoksparet.
Nernstligningen kan brukes på redokssystemet og man har et redokspotensial hvor ΔE er redokspotensialet. Vanligvis brukes en generell referanse - standard hydrogenelektrode, hydrogen ved atmosfæretrykk. Bruker man sølv-sølvkloridelektrode istedet har denne et standard potensial på +210 mV i forhold til hydrogenelektroden ved 25 oC. Redokspotensialet angir elektrontrykket.
Et redokssystem som blir oksidert og overfører elektroner til standard hydrogenelektrode vil ha negativt potensial. Med positivt potensial mottar det elektroner fra standard hydrogenelektrode (det oksiderer).
Et mer negativt redoksssystem kan alltid redusere et mer positivt redokssystem.
Hvis protoner deltar i redokssystemet blir redokspotensialet pH- avhengig, og vi refererer til pH 7
\(\displaystyle \frac{RT}{F}= \log a_{H^+}= 0.059 \cdot pH\)
Hydrogenelektroden ved pH 7 er 7·59 = 420 mV mer negativ enn standard hydrogenelektrode ved pH =0. For alle pH avhengige redokssystemer
XH ⇔ X+ H+ + e-
E'o (pH 7) = Eo - 420 mV
R er den universelle gasskonstanten, T er absolutt temperatur i Kelvin, z er antall elektroner som overføres, F er Faradays konstant, og E'o er referansepotensialet ved pH 7. Man kan erstatte den naturlige logaritmen ln med Briggske logaritmer: 2.303 log. Ved 25oC er 2.303 RT/F er lik 0.0592 V.
Vi har for Gibbs fri energi:
\(\displaystyle \Delta G = \Delta G^o +RT \ln\frac{[\text{produkter}]}{[\text{reaktanter}]}\)
Vi har også:
\(\displaystyle \Delta G= -nF\Delta E \)
ΔE er positiv når ΔG er negativ. Når konsentrasjonen av den oksiderte formen er størst blir redokspotensialet positivt i forhold til referansen Eo. Hvis forholdet oksidert/redusert >1 blir logaritmen positiv og dette betyr at E blir mer positiv enn Eo. Når konsentrasjonen av reduktant er størst dvs. forholdet oksidert/redusert <1 blir logaritmen negativ og E blir mer negativ enn Eo.
Det mer negative redoksparsystem vil donere elektroner til det mer positive parsystem inntil termodynamisk likevekt oppnås.
I metabolismen spiller transport av elektroner og protoner stor rolle som via oksidoreduktaser og i respirasjonskjede og fotosyntese. I fotosyntesen brukes redoksskalaen fra -1000 mV for eksitert reaksjonssenter klorofyll (P680*) til + 815 mV for vann-oksygen-systemet. Når reaksjonssenterklorofyll har avgitt et elektron til feofytin har rreaksjonssenterradikalt P680•+ et potiensal +1200 mV, og kan derved motta elektroner fra vann. Transportmolekylet for reduserende ekvivalenter i fotosyntesen er NAD(P)H.
Vi kan angi elektronaktivitet (pε) analogt til pH som et mål på evnen til en
løsning til å motta eller avgi elektroner:
\(\displaystyle p\epsilon= -log[e^-]\)
pε i overflatevann i likevekt med luft er 13.6 og pε er -4 der hvor sulfid og metan produseres i anaerobe sedimenter.
Selv om vann ikke har frie protoner og fri elektroner kan vi angi relativ protonaktivitet (pH) og relativ elektronaktivitet (pε). H+eksisterer som et hydrat (H3O+), men elektroner gjør ikke dette.
F.eks. for redoksparet NADP+/NADPH i fotosyntesen hvor det blir overført 2 elektroner blir redokspotensialet målt i volt (V)
NAD+ + H+ + 2e- → NADH (-0. 320 V)
NADP+ + H+ + 2e- → NADPH (-0.324)
Ved like mengder av NADPH og NADP+ blir ln 1=0 dvs. midtpunktpotensialet for dette redoksparet i fotosyntesen blir -0.32 V.

Det trengs energi for å overføre elektroner til et stoff med mer negativt midtpunktsredokspotensial. Elektrondonorene har et mer negativt redokspotensial, mens elektronakseptorene har et mer positivt redokspotensialTendensen et redokspar har til å motta eller avgi elektroner til et annet redokspar angis som redokspotensial målt i volt.
Den svenske biokjemikeren Hugo Theorell (1903-1992) og medarbeidere som fikk nobelprisen i fysiologi eller medisin i 1955 for «oppdagelser omkring egenskaper og virkemåte for oksidasjonsenzymer».
Redokspotensialet er et mål på tilgjengeligheten av elektroner. Alle organismene på Jorden skaffer seg energi og lever på potensialsprang på redoksskalaen, og mange mikroorganismer bidrar til redokspotensialet i jord. Redokspotensialet avhenger av hvor sterkt et stoff tiltrekker seg elektroner, samt konsentrasjonen av elektronakseptor og elektrondonor. I oversvømt jord er det mengel på elektronakseptorer og rikelig med elektrondonorer. En gjennomluftet oksygenrik jord har ofte lite elektrondonorer, men har rikelig tilgang på elektronakseptoren oksygen (O2).
Definisjonen av hva som menes med anaerobe (anoksiske) forhold varierer. Mikrobiologene har brukt Pasteurpunkt til å karakterisere oksygenkonsentrasjonen hvor fakultative anaerobe organismer skifter fra aerob respirasjon til fermentering. I eksperimentelle systemer kan de siste rester av oksygen fjernes ved å tilsette sterke reduksjonsmidler som f.eks. dithionitt. 0.1- 5 % av metningskonsentrasjonen i atmosfæren ansees for å være mikroaerob.
Redokspotensialet er pH-avhengig. I biologi angis vanligvis redokspotensialene ved pH=7.0 og er lik forholdet mellom oksidert og redusert form, dvs. redoksparet er 50 % redusert. Dette kalles midtpunktpotensialet (Em). Det er også vanlig i biologi å angi mer negative potensial for redokspar som foretrekker å avgi elektroner enn par som foretrekker å motta elektroner som har et mer positive potensial. For et redokspar hvor x er antall elektroner og y protoner som inngår:
Formel sett inn
blir ved 25 oC redokspotensialet 2.3RT/F(x/y) = 60 mV mer negativt for hver pH-enhet når x/y=1. R er gasskonstanten 8.31 J mol-1 K-1. F er Faraday´s konstant 96000 coulomb mol-1. Volt er et mål på elektrisk potensial og defineres som 1 J coulomb-1.
En oksidasjon vil si å avgi elektroner fra en elektrondonor (reduktant)
elektrondonor (reduktant) ⇔ elektronakseptor (oksidant) + e-
En reduksjon vil si å motta lelektroner fra en elektronakspeotr (oksidant
elektronakseptor (oksidant) + e- ⇔elektrondonor (reduktant)
I mange redoks-reaksjoner er også protoner involvert:
elektronakseptor (oksidant) + mH+ + ne- ⇒ elektrondonor (reduktant)
hvor m og n er henholdsvis antall protoner og elektroner som inngår i reaksjonen. Denne kan også skrives som en likevektsreaksjon:
Formel sett inn
Innen biologi betyr en reduksjon å lagre energi, det vil si motta elektroner, avgi oksygen (O), samt motta protoner (H+), sistnevnte forskjellig fra protonisering i pH-reaksjoner. I fotosyntesen hos planter blir karbondioksid (CO2) redusert til blant annet sukker (C6H12O6), og vann oksidert
2H2O ⇔ 4e- + 4 H+ + O2
6CO2 + 24e- + 24H+ ⇒ C6H12O6 + 6H2O
Andre eksempler på reduksjoner i planter er nitrat (NO3-) som blir redusert til ammonium (NH4+) i en nitratreduksjon før nitrogen kan bli inkorporert i organiske forbindelser. Sulfat (SO42-) blir redusert til sulfid (HS-) i en sulfatreduksjon før det blir assimilert. I biologisk nitrogenfiksering blir nitrogen (N2) fra lufta redusert til ammonium (NH4+).
Elektrondonorer
Eksempler på elektrondonorer er organiske stoffer, vann (H2O) f.eks. fotosyntesen hos planter, ammonium (NH4+) f.eks. ammoniumoksiderende bakterier, ferrojern (Fe2+), mangan (Mn2+) f.eks. manganoksiderende bakterier som oksiderer løselig Mn2+ til uløselig svartfarget manganoksid (MnO2), sulfid (S2-) f.eks. anaerobe fotosyntetiske bakterier, hydrogen (H2) f.eks. hydrogenoksiderende bakterier, og metan (CH4) f.eks. metanotrofe bakterier. Hos mennesker og dyr blir elektroner og protoner fra vann lagret i organiske stoffer i fotosyntesen overført til oksygen i respirasjonskjeden, energien blir frigitt og vannet blir gjendannet.
Oksidering av sukker:
C6H12O6 + 6H2O ⇒ 6CO2 + 24H+ + 24e-
Heterotrofe organismer sørger for opprettholdelsen av kjemisk likevekt ved å oksidere redusert karbon laget i fotosyntese. Det en begrenset mengde elektronakseptorerer tilgjengelig. Ved å koble forskjellige halvreaksjoner gir dette forskjellige mengder energi. F.eks. energiutbyttet ved å oksidere 1 mol karbohydrat med oksygen som elektronakseptor er ca. 6 x høyere enn med å bruke sulfat som oksidant. Oksidasjon av metan med sulfat gir lite energi.
Termodynamiske betraktninger tilsier at de mest energetisk fordelaktige skjer først dvs. organisk materiale omsettes med dioksygen (O2) som elektronakseptor. Etter at O2 er brukt opp brukes nitrat (NO3-) som elektronakseptor, etterfulgt av Mn4+, Fe3+ , SO42- og CO2.
I et sediment vil oksygen forsvinne nær overflaten. Under denne sonen skjer biologisk reduksjon av nitrat, mangan og jern. Under denne suboksiske sonen vil sulfatreduksjon dominere i sulfidsonen hvor sulfid dannes. Under denne sonen er sulfat fjernet og metanogenese vil dominere. Måling av redokspotensial i naturlige omgivelser og kulturer gir bare empirisk informasjon, og redokspotensialet blir vanskelig å forklare kjemisk siden det er flere redokssystemer som måles samtidig.Pt-elektroden er ikke en reversibel oksygenelektrode når den senkes i vann. Potensialet i oksygenrikt sjøvann er fra 400-470 mV istedet for 800 mV som en skulle ha forventet og denne verdien forblir uendret selv om oksygen fjernes ved å flushe med nitrogen. Hvis elektroden dyppes i et anaerobt sedimentet vil verdien falle raskt til 0-200 mV buffret av Fe3+ /Fe2+ systemet. I dypere i sedimentet faller redokspotensialet lavere enn -200 mV hvor S2- → S + e-. Lavere verdi for redokspotensialet f.eks. -300 mV kan skyldes H2.
Elektronakseptorer
Oksygen er den viktigste elektronakseptoren for alt aerobt liv i en oksygenatmosfære, og et stort potensialsprang gjør at mye energi blir frigitt og gjort tilgjengelig under elektrontransporten. Ved fermentering (etanolgjæring og melkesyregjæring) blir det mangel på oksygen, og organismene bruker i stedet organiske stoffer som elektronakseptor, acetaldehyd i alkoholgjæringen og pyruvat ved melkesyregjæring. Andre elektronakseptorer er nitrat (NO3-) f.eks.nitratreduserende bakterier, manganoksid (MnO2), ferrijern (FeOOH) f.eks. jernbakterier, sulfat (SO42-) hos sulfatreduserende bakterier og hydrogenkarbonat (HCO3-) hos metanogene bakterier. I mange av disse tilfellene er det organiske stoffer som er elektrondonor.
Jernbakterier som bruker organiske stoffer i grunnvannet som elektronkilde og ferrijern som elektronakseptor (Fe(OH)3 eller Fe2O3, en reduksjon:
4Fe(OH)3 + 2H+ + 4e- ⇒ 4Fe2+ + 12H2O
Oksidasjon av organisk materiale
CH2O + H2O ⇒ CO2 + 4H+ + 4e-
som i sum gir:
4Fe(OH)3 + CH2O + 8H+ ⇒ 4Fe2+ + CO2 + 11H2O
I overgangssonen til aerobt miljø blir ferrojern oksidert til ferrijern av jernoksiderende bakterier eller abiotisk av oksygen, noe som gir brune jernutfelleringer i myrer og andre fuktige områder:
2Fe(OH)2 + O2 ⇒ Fe2O3 + H2O
Redokspotensial
Standard redokspotensial for hydrogenhalvcellen blir ved pH 7.0 lik -420 mV (7×(-60) mV). I membraner i bakterier, mitkondrier (respirasjon) og kloroplaster (fotosyntesens lysreaksjon) hvor det skjer energioverføring er det en rekke elektrontransporterende redokspar med forskjellig midtpunktpotensial. Det er også mulig å angi mengden fri energi som blir tilgjengelig til å utføre arbeid (Gibbs fri energi G) ved en elektronoverføring mellom redokspar.
Hvis to halvceller kobles sammen med en saltbro med KCl og en Pt-elektrode senkes i hver halvcelle kan en spenningsforskjell måles mellom elektrodene. Den inerte Pt-elektroden er et slags elektronreservoir og potensialet i hver halvcelle avhenger av forholdet mellom oksiderte og reduserte forbindelser. Hvis en av halvcellene (referansecellen) er en hydrogenelektrode pH = 0, 1 atm. H2 og Q=1 vil den målte spenningen være redokspotensialet til den andre cellen. Hvis systemet er lukket vil en strøm passere og den fri energi til systemet minsker. Dette tapet i fri energi er likt det elektriske arbeidet som systmet gjør (ΔG = nFE)
ΔG = ΔGo + RTlnQ, hvor ΔGo er endring i fri energi ved transport av 1 mol elektroner under standard betingelser. I praksis måles redokspotensialet med en Pt-elektrode mot en halvcelle (Ag/AgCl elektrode) ved å bruke et potensiometer med en høy indre resistanse > 1012 Ω og det målte potensialet omdannes til E ved å legge til potensialet til referanseelektroden (relativt til hydrogenelektroden).
H2⇔ 2H+ + 2- (Eo=0 V)
Andre redokspar ut fra om de mottar eller avgir elektroner til standard hydrogenelektrode. De som mottar elektroner har et mer positivt potensial og de som avgir elektroner får et mer negativt potensial.
Biologisk overføring av elektroner skjer enten med enkeltelektroner (n=1) eller elektronpar (n=2). Em er forskjellen i midpunktpotensial mellom elektronmottager og elektrondonor. For å overføre to elektroner fra NADH til oksygen gir
Delta G= 2(0.82-(-0.32))96500=-218 kJ mol-1.
Negativ \(\Delta G\) angir at elektronoverføringen skjer spontant (ikke nødvendigvis raskt) uten forbruk av energi. Overføring av et elektron fra et mer positivt redokspotensial til et par som er mindre positivt krever tilført energi.
En reduksjon gir følgende endring i Gibbs fri energi,
Formel sett inn
R er gasskonstanten 8.31 J K-1 mol-1, T er absolutt temperatur og er standard endring i fri energi.
Litt mer om redoksreaksjoner
Reduksjons- oksidasjonsreaksjoner gir endringer i oksidasjonstall.
Ifølge en kjemiker blir ved en oksidasjon oksidasjonstallet mer positivt (mindre negativt). Ved en reduksjon blir oksidasjonstallet mindre positivt (mer negativt).
Syrer kan reagere med metaller, f.eks. svovelsyre fra et bilbatteri gir rust. Vanligvis er en slik reaksjon mellom syre og metall en redoksreaksjon hvor metallet blir oksidert og syren blir redusert. Når svovelsyre reagerer med metallisk zink på en galvanisert spiker skjer følgende reaksjon:
Zn + H2SO4 → ZnSO4 + H2
Metallisk zink (Zn) blir oksidert til Zn2+ og 2H+ blir redusert til hydrogengass (H2). Protoner (H+) virker som et oksidasjonsmiddel og blir redusert til H2. Sammenlignet med salpetersyre som er en sterkt oksiderende syre kalles svovelsyre og saltsyre for ikke-oksiderende syrer.
Slipper man en kobbermynt i konsentrert salpetersyre (HNO3) blir det en voldsom og farlig reaksjon, og det dannes en brunfarget sky av giftig nitrogendioksid (NO2). Metallisk kobber (Cu) blir oksidert til et toverdig kobberkation (Cu2+), og et anion nitrat (NO3-) blir redusert til nitrogendioksid (NO2):
Cu + 2NO3- + 4H+ → Cu2+ + 2NO2 + 2H2O
Bruker man imidlertid en svak salpetersyreløsningen blir ikke sluttproduktet nitrogendioksid, men derimot nitrogenoksid (NO). Salpetersyre oksiderer også organiske stoffer svært godt og gir derfor alvorlige hudskader hvis det søles på huden, både syre- og oksidasjonsskader.
Dyppes metallisk zink (Zn) i en løsning med kobbersulfat (CuSO4) blir zinkmetallet brunfarget av metallisk kobber (Cu):
Zn + CuSO4 → Cu +ZnSO4
Zink reduserer kobberioner til metallisk kobber, og kopperioner oksiderer metallisk zink (Zn) til zinkkationer (Zn2+). Derimot skjer det ingen reaksjon om metallisk kobber dyppes i en løsning med zinksulfat.
Metallisk natrium reagerer kraftig og eksplosivt med vann hvor vann blir redusert til hydrogengass og natrium blir oksidert il Na+.
Lavoisier oppdaget at forbrenning er en reaksjon mellom trevirke eller kull og oksygen (O2) i lufta. Oksidasjon betydde en reaksjon mellom en reaktant og oksygen, men seinere oppdaget man at dette var bare en spesiell del av mange typer oksidasjon. Oksygen er at aktivt oksidasjonmiddel. Forbrenning kan skje raskt hvor både lys og varme avgis.
Fossilt brennstoff inneholder karbon og hydrogen. Når metan (CH4) forbrenner dannes karbondioksid (CO2) og vann (H2O), en redoksreaksjon ved høy temperatur, i motsetning til enzymkatalyserte redoksreaksjoner i levende organismer som skjer ved biologisk temperatur :
CH4 + 2O2 → CO2 + 2H2O
Er det dårlig oksygentilgang blir forbrenningen ufullstendig og det dannes giftig karbonmonoksid (CO), også kalt kullos. Her er det brukt metan som eksempel, men det gjelder alle hydrokarboner:
CH4 + 3/2 O2 → CO + 2H2O
Kull til grilling må bare brukes utendørs hvor det er nok oksygen til fullstendig forbrenning. Karbonmonoksid (CO) som er luktfri binder seg til den terminale oksidasen i respirasjonskjeden (elektrontransportkjeden) i mitokondriene i cellene, noe som kan ende med en tragisk død. Vær alltid obs hvis det skjer en forbrenning med dårlig tilgang på oksygen. Det kan være et alvorlig faresignal.
Hvis det er svært dårlig oksygentilgang dannes det rent karbon i form av sot, og en ulmebrann kan sote ned et helt hus eller leilighet:
CH4 + O2 → C + 2H2O
Når man skal lage trekull forbrennes trevirke ved lav oksygentilgang slik at det dannes kull. I en tjæremile omdannes fururøtter med høyt harpiksinnhold til tjære ved forbrenning ved lav oksygenkonsentrasjon.
Hvis fossilt brennstoff inneholder svovel vil det i tillegg dannes svoveldioksid (SO2).
Metaller kan også forbrenne. I gamle dager brukt man blitzpærer med magnesiumtråder og ble det sendt strøm inn i trådene ble det varmt nok til at det tente.
Når etanol (C2H5OH) brenner i en spritbrenner, eller i et rødspritkokesett på telturen:
C2H5OH + 3O2 → CO2 + 3H2O
Generelt reagerer metaller sakte med oksygen i en reaksjon som kalles korrosjon eller rust. Metallisk jern (Fe) oksideres til rust, jernoksid, Fe2O3 ·H2O.
Jern virker som en anode:
Fe → Fe2+ + 2e- (anode)
Elektroner (e-) fraktes til et sted hvor jern er i fuktig kontakt med oksygen og hvor det skjer en reduksjon:
1/2 O2 + H2O + 2e- → OH-
Toverdig ferrojern (Fe2+) diffunderer og kommer i kontakt med hydroksylioner (OH-) og felles ut som jernhydroksid ( Fe(OH)2), og blir videre oksidert av oksygen i lufta til Fe(OH)3 som taper vann og gir rust (Fe2O3).
2Fe(OH)3 → Fe2O3 + 3H2O
Fe2+ kan diffundere under billakk og gjør at lakken bobler opp pga. rust.
Katodebeskyttelse med dekke av et annet metall kan hindre rust. Katodebeskyttelse beskytter jernet med et metall som lar seg lettere oksidere enn jern, det vil si at jern blir katode og det andre metallet blir anode.
Galvanisering med zink gir en slik beskyttelse. Jfr. galvanisert spiker og galvaniserte bildeler. I båter i saltvann kan man bruker en offeranode med zink, som erstattes med en ny når den er oppbrukt. H+ kan ikke oksidere kobber.
H+ i saltsyre (HCl) kan være oksidasjonsmiddel og bli redusert til hydrogengass (H2), men både saltsyre og svovelsyre har dårlige oksidasjonsegenskaper og kalles ikke-oksiderende syrer.
Salpetersyre (HNO3) er eksempel på en oksiderende syre hvor anionet nitrat i syren er sterkere oksidasjonsmiddel enn H+, og nitrat blir redusert. På grunn av de oksiderende egenskapene gir salpetersyre alvorlige skader hvis den søles på huden, som tidligere nevnt.
Blanding av kobber og saltpetersyre gjør at kobberet blir oksidert og nitrat redusert til nitrogendioksid som er en brungul giftig gass:
Cu + 4HNO3 → Cu(NO3) + 2NO2 + 2H2O
Kaliumpermanganat (KMnO4) kan brukes til redokstitreringer. MnO4- er purpurfarget, mens Mn2+ er fargeløs.