Kjernekjemi og transmutasjoner
Atomkjernen til noen av isotopene er ustabile. Ustabile atomkjerner er radioaktive og avgir en høyenergistrøm av partikler eller stråling. Radioaktive isotoper kalles radionuklider og de tilhørende kjemiske endringer kalles kjernereaksjoner.

Marie Sklodoska (Curie) (1867-1934), gift med Pierre Curie (som hun traff under studiene av fysikk og matematikk ved Sorbonne) oppdaget de radioaktive isotopene radium og polonium (oppkalt etter hjemlandet Polen) . Madame Curie, som hun også ble kalt, gjorde også studier av radioaktiviteten til uran og thorium. Hennes laboratorienotater er framdeles radioaktive. Hun fikk nobelprisen i fysikk i 1903 (sammen med Henri Becquerel og Pierre Curie) og nobelprisen i kjemi i 1911. Hun var den første som fikk nobelprisen to ganger, og den første kvinne som fikk den alene (Den neste var Barbara McClintock for oppdagelsen av transposoner). Gravlagt i Panthéon i Paris (1995).

Henri Becqurel oppdaget radioaktiviteten fra uran, og har fått måleenheten for radioaktivitet, 1 beceuerel (Bq) = 1 desintegrasjon per sekund oppkalt etter seg, den eldre måleenheten for radioaktivitet var Curie (Ci).
Albert Einstein (1879-1955) viste at det er overgang mellom masse og energi, på samme måte som mellom potensiell energi og kinetisk energi:
potensiell energi ⇔ kinetisk energi
masse ⇔ energi
Energi som blir frigitt (ΔE) ved endring av masse (Δm) er:
\(\Delta E = \Delta m c^2\)
hvor c er lyshastigheten c=3.00·108 m s-1.
Det betyr at en liten endring i masse representerer store energimengder. Summen av all energi i universet er konstant. Et masse som beveger seg med lysets hastighet vil ha en uendelig stor masse, og er derfor en umulighet. Massen til en atomkjerne er alltid litt mindre enn summen av hvilemassen til nukleonene (protoner og nøytroner). Jo høyere bindingsenergi, desto mer stabil er kjernen.
Otto Hahn og Fritz Strassman viste at når uran ble spaltet ved fisjon ble det laget flere lettere isotoper bl.a. barium-40 med atomnummer 56. De to tyske fysikerne Lise Meitner og Otto Frisch viste at en av de sjelde uranisotopene, uran-235 kan spaltes i omtrent to like deler etter innfangning av et nøytron:
\(_{92}^{235}U + _0^1n \rightarrow \; X + Y + b_0^1n\)
hvor X og Y er minst 30 forskjellige isotoper, hvorav mange av dem sender ut sekundære nøytroner, b = 2.47
Hvis man lager en grafisk framstilling av alle kjente stabile og ustabile isotoper med antall protoner som de inneholder på x-aksen og antall nøytroner de inneholder på y-aksen vil de stabile isotopene befinne seg i en stabilitetssone hvor det er ca. et 1:1 forhold mellom nøytroner og protoner. På oversiden av stabilitetssonen er det overskudd av nøytroner og i denne sonen er det mange ustabile isotoper som sender ut betastråling. På undersiden av stabilitetssonen er det flere protoner enn nøytroner og i denne sonen finner man positronemittere.
Det viser seg at hvis antall nøytroner og protoner i kjernen begge er liketall så er disse isotopene mer stabile enn om antall nøytroner og protoner begge er oddetall. Dette skyldes at nukleonene har spin, akkurat som elektronene. Parvise protoner og nøytroner har parvise spin og lavere energi enn om det skulle være et uparet nukleon. Noen nukleontall er mer stabile enn andre: 2, 8, 20, 28, 50, 82 og 126 f.eks. Helium (2 protoner), oksygen-16 (8 protoner) og kalsium-40 (20 protoner).
Ca. 50 av de 350 naturlig forekommende isotopene er radioaktive og kan sende ut alfastråling, betastråling eller gammastråling. Lager man en grafisk framstilling av isotopenes atomnummer på x-aksen og bindingsenergien på y-aksen får man en kurve med en flat topp hvor blant annet jern-56 befinner seg, og som er den mest stabile. Høyt massetall gir isotoper som kan fisjonere, og i motsatt ende av kurven er de letteste av isotopene som kan fusjonere. Bortsett fra hydrogen har alle atomer mer enn ett proton i kjernen, og siden protoner har positiv ladning vil de frastøte hverandre. Imidlertid er det sterke kjernekrefter som holder protonene sammen og motvirker den elektrostatiske frastøtningen, og nøytronene bidrar til å skape avstand mellom protoner.
Ustabile atomkjerner vil desintegere, og kan sende ut alfapartikler (heliumkjerner med ladning +2), betapartikler, gammastråling eller positronstråling. Kunstige radionuklider kan sende ut positronstråling, og noen har elektroninnfangning. Hvis et positron kolliderer med et elektron annihileres de og det sender ut to fotoner gammastråling. Naturlige isotoper over atomnummer 83 har lange halveringstider.
Energien til strålingen måles i elektronvolt (eV). 1 eV er energien som ett elektron mottar når det blir aksellerert av en spenning 1 volt.
1 eV = 1.602·10-19 joule (J)
1MeV= 106 eV
1 eV= 1.783·1036 kg
Atomkjernen hos grunnstoffene i periodesystemet er bygget opp av Z protoner og N neutroner, som til sammen gir massetallet eller nukleontallet A,
A = Z + N
Antall protoner bestemmer plasseringen i periodesystemet. Isotoper av et grunnstoff har således samme antall protoner (Z), men forskjellig antall nøytroner (N) i atomkjernen. Radioisotoper er radioaktive. Et atom (nuklide) kan beskrives som:
\(_Z^AX\)
hvor X er det kjemiske symbolet til atomet. Z angir antall protoner i kjernen (atomnummer), N angir antall nøytroner i kjernen og A er massetallet (nukleontallet) og er lik summen av antall protoner og nøytroner. For eksempel har den radioaktive isotopen cesium-137 (137Cs ) massetall 137, med 55 protoner og 82 nøytroner.
Isotoper er nuklider (atomer) med samme antall protoner, men forskjellig massetall (gr. isotopos - samme plass). Ifølge atommodellen til Rutherford-Bohr er kjernen omgitt av elektronskall, for eksempel K L M. Forholdet mellom nøytroner og protoner kan gi ustabilitet i atomkjernen, og dette kan gi opphav til radioaktive isotoper.
Kjernemassen (M) er alltid mindre enn summen av massen (Mp) til protoner (Z) pluss massen (MN) til nøytroner (N). Forskjellen utgjøres av bindingsenergien til atomet:
Matom < Z Mp + N MN + Z Me
Desintegrasjon og sammenfall av radioaktive nuklider kan skje ved:
Alfastråling (α) med utsendelse av heliumkjerner.
Betastråling (β) med utsender av negatroner (β-) eller positroner (β+, positronstråling) fra atomkjernen med et kontinuerlig energispektrum fra minimum til maksimum energi, samt elektroninnfanging. Siden beta-spekteret er kontinuerlig kan all kjerneenergien havne i betapartikkelen, men for alle energinivåer fra maksimum og nedover må noe av energien havne i en ekstra partikkel uten ladning og masse, et neutrino (ν) med spin 1/2. I noen tilfeller skjer det en blandet desintegrasjon (sammenfall) av den ustabile atomkjernen. Ved en greinet desintegrasjon blir det dannet to eller flere datternuklider. Hvis datternukliden også er ustabil skjer det suksesiv desintegrasjon i en radioaktiv serie
Gammastråling (γ) med utsendelse av energirik elektromagnetisk stråling.
Isotoper har forskjellige kjemiske og fysiske egenskaper, som hydrogenisotopene hydrogen (1H, proteum), den stabile deuterium (2H, D) for eksempel i tungtvann (D2O), og radionukliden tritium (3H, T).
I naturen er det forskjellige forhold mellom de forskjellige isotopene av et grunnstoff avhengig av hvilket materiale de inngår i. Isotopforholdet bestemt i et massespektrometer kan gi viktig naturvitenskapelig informasjon. Eksempler på isotopforhold er karbon 12C/13C, oksygen 18O/16O, bor 13B/10B, litium 7Li/6Li
I det periodiske system er grunnstoffene (elementene) ordnet etter atomnummer dvs. antall protoner i kjernen. Grunnstoffene i en gruppe (kolonne) har samme antall og type av ytre elektroner. De har derved også mange like egenskaper. For hver rad i det periodiske systemet er det et nytt elektronskall. Dette betyr at cesium får egenskaper som ligner på kalium, strontium får egenskaper som kalsium, og teknesium ligner mangan.
Forurensning av miljøet med radioaktive isotoper av cesium, plutonium og strontium er de som skaper mest bekymring på lang sikt. Kortlivete isotoper, inklusive kortlivete radioaktive jodisotoper, forsvinner etter hvert. Jod vil imidlertid ved sin sterke opphopning i skjoldbruskkjertelen hos mennesker representere et akutt radioaktivt stråleproblem, spesielt hos barn. Jod-131 desintegrerer til xenon-131 med utsendelse av både betapartikler og gammastråling med forskjellig energi (keV)
Naturlig bakgrunnsstråling
Mange radioaktive isotoper av grunnstoffer er naturlig forkommende i naturen. Noen blir dannet ved kosmisk stråling med nøytroner som kan gi opphav til tritium (3H) og karbon-14 (14C). Med raske nøytroner skjer reaksjonen:
Med termiske nøytroner skjer reaksjonen:
Atombombeprøver i atmosfæren og atomkraftulykker har gitt økt mengde av 14C i naturen. Kalium-40 (40K), rubidium-87 (87Rb), uran-235(235U), uran-238 (238U) og thorium-232 (232Th) er eksempel på naturlig forekommende radionuklider med meget lang halveringstid. Kalium 40 (40K) med halveringstid 1.251·109 år som desintegrerer til kalsium-40 (40Ca) med tilhørende beta- og argon-40 (40Ar) fra gammastråling og elektroninnfanging. Den andre viktige radioaktive isotopen i bakgrunnsstråling er radon (222Rn) med halveringstid 3.82 dager og alfa-stråling. Innholdet av 40K utgjør 0.012% av det totale kalium, men siden organismene inneholder høye konsentrasjoner kalium blir dette en viktig form for naturlig bakgrunnsstråling. Desintegrasjonen kalium-argon blir brukt til radiologisk datering. Naturlig uran inneholder 99.3% uran-238 (238U) og 0.71% uran-235 (235U), mens naturlig thorium består av 100% thorium 232 (232Th), og disse er utgangsmateriale for radioaktive serier, uranserien fra 238U, aktiniumserien fra 235U og thoriumserien fra 232Th . Som kjernebrensel i atomreaktorer må man ha rent uran laget ved isotopseparasjon og anrikning, siden andre radionuklider kan gi nøytroninnfanging og bremse kjernereaksjonene.
Det er tre naturlige radioaktive serier i naturen er med datternuklidene
1) Uran-radiumserien som starter med uran-238 (238U) og ender med bly-206 ( 206Pb).
238U → (α) 234Th → (β) 234Pa → (β) 234U → (α) 230Th → (α) 226Rn → (α) 222Rn → (α) 218Po → (α) 214Pb → (β) 214Bi → (β) 214Po → (α) 210Pb → (β) 210Bi → (β) 210Po → (α) 206Pb
2) Thoriumserien 232Th → 208Pb
232Th → (α) 228Ra → (β) 228Ac → (β) 228Th → (α) 224Ra → (α) 220Rn → (α) 216Po → (α) 212Pb → (β) 212Bi → (β) 212Po → (α) 208Pb
3) Actiniumserien 235U → 207Pb
235U → (α) 231Th → (β) 231Pa → (α) 227Ac → (β) 227Th → (α) 223Ra → (α) 219Rn → (α) 215Po → (α) 211Pb → (β) 211Bi → (α) 207Tl → (β) 207Pb
Desintegrasjon (forvandling og sammenfall i atomkjernen)
ß--stråling (betastråling)
Har en ustabil kjerne et nøytronoverskudd vil et nøytron (n) omdannes til et proton (p+) pluss et elektron (ß--partikkel, e-) og et antinøytrino . Dette kalles ß--desintegrasjon.
Betastråling består av en strøm med betapartikler (elektroner) og antineutrinoer som kommer fra atomkjernen:
nøytron (n) → proton (p+) + elektron (e- ) + antinøytrino
\(_0^1 n \rightarrow _{-1}^{\; \; 0} e +\; _1^1p\; + \; \overline \nu\)
Overskuddet av energi ved masseforandringen fjernes som kinetisk energi til ß-partikkelen. For å kunne forklare at man har et kontinuerlig ß-spektrum må det være et antinøytrino som også kan fjerne energi fra kjernen. Antinøytrino har neglisjerbar masse, ingen ladning og beveger seg med tilnærmet lysets hastighet. Aktiviteten til svake beta-emittere kan bli målt med scintillasjonstelling.
Betapartiklene kommer fra desintegrasjon av kjernen, ikke fra elektronskallene rundt kjernen. Betapartiklene fra desintegrasjon av en isotop har et energispektrum fra null til en øvre grense for de mest energirike betapartiklene. For å kunne forklare denne forskjellen i energi for betapartiklene foreslo William Pauli i 1927 at betapartiklene følges av en elektrisk nøytral partikkel uten masse. Enrico Fermi (1901-1954) forslo navnet neutrino på denne partikkelen og den ble seinere kalt antineutrino.
Eksempler på radioaktive isotoper som sender ut betapartikler (betastråling) er tritium (H-3, 3H), jod-131 (131I), karbon-14 (14C), svovel-35 (35S), fosfor-32 (32P), alle mye brukt innen laboratorieforskning, samt strontium-90 (90Sr).
\(_1^3H \rightarrow _2^3He \;\; E_{max}=18\;keV\;\;t_{\frac{1}{2}}=12.26\; år\)
\(_6^{14}C \rightarrow _6^{14}N \;\; E_{max}=156\;keV\;\;t_{\frac{1}{2}}=5730\; år\)
\(_{16}^{35}S \rightarrow _{17}^{35}Cl \;\; E_{max}=167\;keV\;\;t_{\frac{1}{2}}=87.2\; dager\)
\(_{15}^{32}P \rightarrow _{16}^{32}S \;\; E_{max}=1710\;keV\;\;t_{\frac{1}{2}}=14.3\; dager\)
Eksempel på kjernereaksjoner med betastråling (negatron emisjon) for noen isotoper tidligere mye brukt i biologisk forskning. Emax er den maksimale energien for betastrålingen målt i kiloelektronvolt (keV) i det kontinuerlige energispekteret. Halveringstiden er t1/2. En elektronvolt (eV) er energien som blir mottatt av et elektron når det akselereres gjennom et potensialvelt på 1 volt (V), tilsvarer 1.6·10-19 joule (J)
Cesium-137 (137Cs) fra atombombeprøver og kjernekraftverk omdannes til barium-137 (137Ba) samtidig med utsendelse av gamma- (γ) og betastråling (elektroner (e-)), og halveringstiden for cesium-137 er 30 år.
\(_{\;55}^{137}Cs \rightarrow _{-1}^{\;\; 0}e \;+\; _0^0\gamma\; \;+\; _{\;56}^{137}Ba \)
Alkaliemetallet cesium i gruppe 1 i periodesystemet har mange like egenskaper med kalium og blir tatt opp av plantene via opptakssystemet for kalium og kommer videre fra plantene over i dyr og mennesker, og med halveringstid 30 år har man “gleden” av denne radioaktive isotopen ute i naturen i minst 100 år etter et kjernekraftuhell. Jfr. fremdeles er det enkelte steder i Norge nedforing av sau etter Tsjernobyl.
Radioaktivt strontium-90 (90Sr) følger kalsium inn i beinvevet, radioaktivt jod havner i bukspyttkjertelen (jfr. jodtabletter etter kjernekraftuhell), samt radioaktivt technesium følger mangan.
En betapartikkel forandrer hastighet når den er nær en tung atomkjerne og sender ut bremsestråling. Bremsestrålingen blir høy i nærheten av isotoper med høyt antall protoner (Z). Derfor velger man beskyttelsesmateriale med lav Z, for eksempel perspex-plate brukt som beskyttelse mot svake betaemittere, mens man velger bly for gamma- og alfastråling.

Teoretisk dobbel betastråling uten utsendelse av nøytrino. Kjernefysikk ved Dubna.
β+-stråling (positronstråling)
Positron og positronstråling oppstår når et proton i kjernen omdannes til et nøytron og et positron. Isotoper som sender ut positivt ladete elektroner, for eksempel fluor-18 (18F).
proton (p) → n (nøytron) + β+ (positron) + neutrino
For eksempel
\(_{27}^{54}Co\; \rightarrow \; _{26}^{54}Fe\; + _1^0e\; \left(positron\right)\;+\; \nu\; \left(nøytrino\right)\)
\(_{11}^{22}Na\; \rightarrow \; _{10}^{22}Ne\; + _1^0e\; \left(positron\right)\;+\; \nu\; \left(nøytrino\right)\)
Positronet har bare kort levetid før det kolliderer med et elektron og annihileres, hvorved det sendes ut gammastråling.
positron + elektron → gammastråling
\(_1^0e\;\left(positron\right)\;+\; _{-1}^{\; \; 0}\; \left(elektron\right)\; \rightarrow \; 2\; _0^0\gamma\; \left(gamma\right)\)
Positroner betraktes som antimaterie siden de reagerer med materie. Som positronkilder ved positron emisjon tomografi (PET, PET skanning) i medisinske undersøkelser brukes syntetiske radionuklider som sender ut positronstråling, og gammastrålingen fra annhileringen måles : nitrogen-13 (13N), karbon-11 (11C) , oksygen-15 (15O) eller fluor-18 (18F)
\(_1^1p\: \left(proton\right)\; \rightarrow\; _0^1n\; \left(nøytron\right)\; +\; _1^0e\; \left(positron\right)\)
\(^{18}_{\;9}F \rightarrow ^o_1e\; (^0_1 \beta) + \nu \;+ ^{18}_{\;9} O\)
Fluor-18 sender ut et positron og antineutrino og blir omdannet til isotopen oksygen-18. Positron er antimaterie, reagerer raskt med materie og sender ut gammastråling.
Kreftceller har svært aktiv glykolyse, og fluor-18-merket deoksyglukose samler seg i områder med kreftceller. Utsendelse av positroner blir slukt (annihilerer) av elektroner, og det blir sendt ut gammastråling som kan bli registrert i PET-scanning (positronemisjonstomografi) . 18F har halveringstid 109.77 minutter.
Glukose-C11 kan passerer blod-hjernebarrieren. Positronene forsvinner raskt og det sendes ut gammastråling innenfra kroppen som kan registreres i tomografen. I motsetning til røntgenstråling utenfra som man bruker når det tas røntgenbilder. PET kan bl.a. brukes til å studere endring i hjernen ved kreft, Alzheimer etc. Man benytter ofte fluoro(18F)deoksyglukose , som er en glukoseanalog, men som ikke blir metabolisert. Den akkumuleres i cellevev med stort energibehov, bl.a. metastaserende kreftceller. Fluorisotopen F-18 (18F) lages i en syklotron via protonstråling av O-18 (18O)-anriket vann.
Perteknat TcO4- akkumuleres i hjernesvulster og metastabil teknesium-99m sender ut gammastråling når den omdannes til teknesium-99 (99Tc).
Elektroninnfanging
Elektroninnfangning skjer vanligst hos syntetiske radionuklider hvor et proton i atomkjernen fanger inn et elektron fra K-skallet og danner et nøytron:
proton (p) +elektron (e-) fra indre K-skall → nøytron (n) + røntgenstråling
\(_{\:53}^{125}I \rightarrow\; _{\;52}^{125}Te\)
α-stråling (alfastråling, heliumpartikler)
Utsendelse av to protoner pluss to nøytroner (=heliumkjerne) fra kjernen. α-strålingen er sterkt ioniserende. Ved desintegrasjonsprosessen blir mornukliden omdannet til datternuklider, ofte i radioaktive serier.
Alfapartikler er store og kommer bare noen få centimeter i luft. Alfapartikler trenger ikke gjennom huden, men gir brannskader på huden. I lunger og mage-tarmkanal kommer alfapartiklene i kontakt med bløtt vev og strålingen kan bidra i utvikling av kreft.
F.eks. alfapartikler fra desintegrasjon av uran-238 (238U) til thorium-234 (234Th):
\(_{\; 92}^{238}U \rightarrow _{\; 90}^{234}Th + _2^4He\)
Summen av massetall og atomnummer på hver side blir like. Andre radioaktive isotoper som sender ut alfastråling er radium-226 (226Ra), radon-222 (222Rn) og polonium-210 (210Po). Radium-226 sender ut både alfa- og betastråling og omdannes til radon-222 i den radioaktive serien som ener i bly-206..
γ-stråling (gammastråling)
Ofte når atomkjernen bare et eksitert eller metastabilt nivå etter utsendelse av en ß--partikkel. Resten av energien fra det metastabile nivået kan frigis ved utsendelse av et γ-foton. γ-stråling er elektromagnetisk stråling med lang rekkevidde.
Gammastråling er elektromagnetisk stråling (fotoner) med høy energi og skyldes faseoverganger mellom energinivåer i atomkjernen. Gammastråling (høyenergifotoner) følges ofte sammen med alfa- eller betastråling. Når atomkjernen har sendt ut en alfa- eller betapartikkel kan det bli igjen en restenergi i kjernen, og denne restenergien sendes ut som gammastråling med en bestemt og karakteristisk energi før kjernen faller ned til en stabil grunntilstand. Gammastråling har lang rekkevidde og kan trenge dypt ned i cellevev. Isotopene kobolt-60 og cesium-137 sender ut gammastråling. Gammastrålingen fra kobelt-60 (60Co) brukes i stråleterapi ved kreftbehandling, og sender ut energirike fotoner med energi 1.173MeV og 1.332 MeV.
Marie Curie (1867-1934) oppdaget radium-226 som sender ut alfapartikler og gammastråling, et mellomprodukt ved nedbrytning av uran-238. Radon er en edelgass med halveringstid 4 dager. Både gammastråling og røntgenstråling er elektromagnetisk stråling med fotoner. Mens gammastråling er et resultat av prosesser i atomkjernen, skyldes røtngenstråling prosesser utenfor atomkjernen. Gammastråling i reaksjon med kropp, stoff og materiale kan gi:
1) Fotoelektrisk effekt med utsendelse av et elektron fra stoffet hvor all energien i gammastrålefotonet blir overført til elektronet.
2) Comptonspredning (Arthur Compton) hvor bare en del av energien i gammastrålingen blir overført til et elektron i stoffet, den blir spredt og resten sendes ut som gammafotoner med lavere energi (lengre bølgelengde).
3) Pardannelse hvor det sendes ut et positron (antipartikkel) og et elektron (elementærpartikkel). Disse to typer partikler kolliderer med hverandre (annhilerer) og sender ut gammafotoner.
Røntgenstråling (X-ray)
Røntgenstråling er elektromagnetisk stråling og kan sendes ut fra kunstige radionuklider. Røntgenstråling er høyenergi elektromagnetisk stråling, men med mindre energi enn gammastråling. I et røntgenapparat sendes en elektronstråle mot en metallplate hvor elektronene slår ut elektroner i metallet og etterlater seg hull. Hvis hullet lages i et orbital med lav energi faller et elektron fra høyere orbital ned i hullet og dette gir en kjedeeffekt og det sendes ut energi når elektronene faller ned. Røntgenstråling skyldes overgang mellom elektronnivåer, mens gammastråling skyldes forskjellige energinivåer i atomkjernen.
Çerenkov-stråling
Ingenting kan bevege seg fortere enn lys i vakuum, men betapartikler i vann kan bevege seg raskere enn lys og det sendes ut et blålig lys kalt Çerenkov-stråling. På bilder av uranstaver nedsenket i vann i en atomreaktor kan man se at det sendes ut blåfarget lys. Dette prinsippet kan brukes til å måle mengden betastråling av isotopen fosfor-32 (32P) hvor isotopen puttes i scintillasjonsglass med vann i en scintillasjonsteller.
Halveringstid
En radioaktiv nuklide vil forsøke å nå en stabil tilstand. Dette kan skje i flere trinn. Ved desintegrasjon (forvandling i atomkjernen) dannes en datternuklide. Hver ustabil kjerne av en nuklide har samme sannsynlighet for å desintegrere per tidsenhet. Sannsynligheten kalles nedbrytningskonstanten lambda (λ) Ved radioaktiv desintegrasjon av den ustabile kjernen i mornukliden blir det dannet til en datternuklide med en bestemt sannsynlighet. Sannsynligheten for en desintegrasjon skjer tilfeldig i tid, og følger således en Poisson-sannsynlighetstetthetsfunksjon. For en Poisson-fordeling, tellinger av hendelser som skjer tilfeldig i tid eller rom, er standardavviket lik kvadratroten av telletallet. Det er N stabile mornuklider ved tid t, og forandringen i antall radioaktive mornuklider (N) per tidsenhet (dN/dt) blir i en1. ordens reaksjon. Nedbrytningen av en radioaktiv nuklide over tid t skjer ifølge differensialligningen
\(\frac{dN}{dt}= -\lambda N\)
Nedbrytningskonstanten lambda (λ) angir en karakteristisk egenskap for en radioaktiv isotop.
Analytisk løsning av ligningen:
\(N=N_0 e^{-\lambda t}\)
Vi kan finne halveringstiden t1/2 (eller doblingstiden for noe som øker):
\(2N_0=N_0e^{-\lambda t_{1/2}}\)
Vi forkorter vekk N0 og tar logaritmen på begge sider av likhetstegnet:
\(\ln 2=\lambda t_{1/2}\;\;\;\ \implies t_{1/2}=\frac{\ln 2}{\lambda}\)
Etter kjernekraftulykken ved Tsjernobyl i 1986 ble det bl.a. sluppet ut store mengder radioaktive isotoper bl.a. xenon, jod, cesium-isotoper, og strontium. En av cesiumisotopene cesium-137 (137Cs) som sender ut betastråling (elektroner, e) og gammastråling (γ) og har halveringstid 30 år. Cesium hører med til alkalimetallene og står i samme gruppe som kalium i det periodiske system. Det betyr at cesium og kalium har mange like egenskaper, og er det cesium tilstede vil plantene ta opp cesium, og viderefører dette til beitende dyr for eksempel sau.
\(\displaystyle^{137}_{\;55}Cs \rightarrow ^0_{-1}e + ^0_0\gamma + ^{137}_{\;56}Ba\)
Nedbrytningskonstanten lambda= ln2/30= 0.02310491
Vi kan se at i år 2016, 30 år etter ulykken har vi fremdeles halvparten (50%) av opprinnelig mengde
\(N=1\cdot e^{-0.02310491 \cdot 30}=0.5\)
Hvilket betyr at vi kan ha mye ”glede” av denne ulykken med nedforing av sau og reinsdyr (i hvert fall hvis det hadde vært samme tiltaksgrense for rein som for sau) mange år nedover.
Analytisk løsning av ligningen for eksponensiell nedbrytning
Analytisk løsning av differensialligningen gir: ved å ta integralet på begge sider av likhetstegnet:
\(\displaystyle \int \frac{dN}{N}=- \lambda \int dt\)
\(\ln N=-\lambda t + C \)
Ved tid t=0 har vi utgangsantallet med radioaktive atomer N0 dvs. ln N0 = C.
\(\ln N_0=C\)
Settes dette inn for integrasjonskonstanten C får vi:
\(\ln N=- \lambda t+ \ln N_0\)
som gir ifølge regneregler for logaritmer (logaritmen til en brøk er logaritmen til teller minus logaritmen til nevner):
\(\displaystyle \ln \frac{N}{N_0}=-\lambda t\)
Hvis man lager en grafisk framstilling av ln N/No versus tiden t gir dette en synkende rett linje med stigningskoeffisient -λ. ln er naturlige logaritmer med grunntall det naturlige tallet e (Eulers tall), i motsetning til log som er Briggske logaritmer med grunntall 10.
Ved å bruke eksponentialfunksjonen (e) på begge sider av likhetstegnet blir dette:
\(\displaystyle N=N_0 e^{- \lambda t}\)
dN/dt kalles ofte aktivitet (A). Siden aktiviteten er proporsjonal med N blir:
\(A=A_0 e^{- \lambda t}\)
Den radioaktive halveringstiden vil si den tiden det tar før aktiviteten er redusert til halvparten av opprinnelig verdi. Da er A lik No/2, hvor No er aktiviteten ved tid t=0. Da blir t1/2
\(\displaystyle t_{\frac{1}{2}}=\frac{\ln 2}{\lambda}=\frac{0.693}{\lambda}\)
Det er t1/2 som kalles halveringstiden. Dette er eksempel på en første ordens reaksjon. Plottes N/No semilogaritmisk mot tiden t fås en rett linje.
Måleenheter for radioaktivitet
Enheten for måling av radioaktivitet er bequerel. En bequerel vil si at en nuklide desintegrerer per sekund (dps).
1Bq = 1 dps
For den gamle måleenheten curie (Ci)
1Ci = 3.7·1010 dps = 37 GBq, strålingen fra 1 g radium.
Hvis man har en blanding av for eksempel en C-14-merket aminosyre og en tilsvarende ikke-radioaktiv aminosyre kan man regne ut den spesifikke aktiviteten målt i Bq per mol. I et måleinstrument klarer man ikke å registrere alle desintegrasjonene, for eksempel desintegrasjoner per minutt, dpm, men måler antall tellinger per minutt (Counts per minute, cpm). Fra telleeffektiviteten kan man regne seg tilbake til antall desintegrasjoner.
Absorbert stråledose måles i gray (1 gray = 1 J kg-1). Tsjernobyl "killing zone" for planter var ca. 100 Gy.
Doseekvivalenten måles i sievert (1 sievert = 1 J kg-1). Ved utregningen av doseekvivalenten tar man hensyn til hvilken stråletype man har med å gjøre. Absorbert dose multipliseres med en kvalitetsfaktor Q. For ß- - og γ-stråling er Q=1, for alfastråling Q=20. Graden av ionisasjon som strålingen forårsaker gir alfapartikler 104 ionisasjoner, betastråling 100 ionisasjoner og gammastråling 1 ionisasjon. Det vil si alfastråling virker sterkt ioniserende
Kjernereaksjoner: fisjon og fusjon
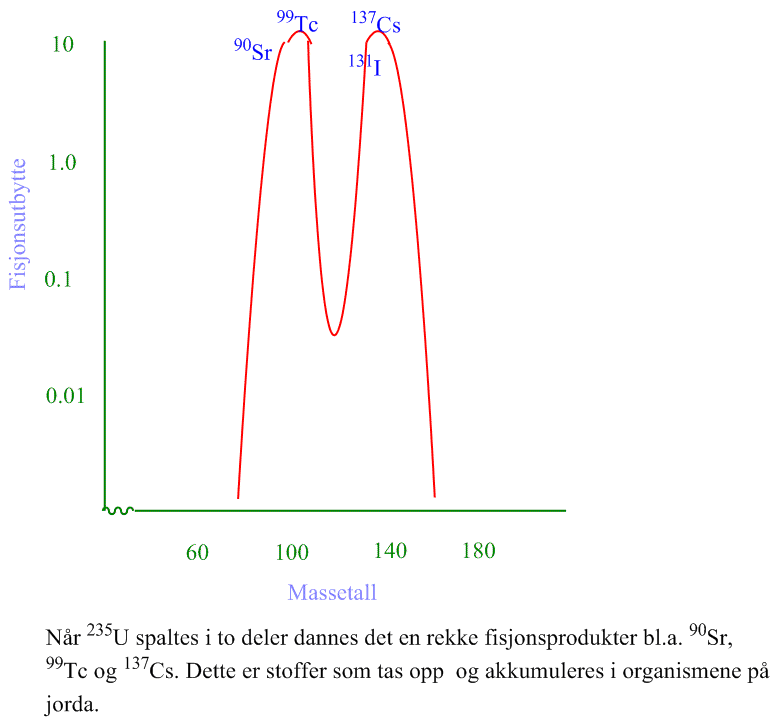
Nøytronstråling er en type kjernereaksjon hvor det dannes et nytt grunnstoff.
Enrico Fermi oppdaget at nøytrale termiske nøytroner som beveger seg sakte kan fanges i atomkjernen. Tyske kjemikere Otto Hahn og Fritz Strassman oppdaget i 1939 at fisjon av urankjernen produserte isotoper som var lettere enn uran, og uran ble delt i omtrent i to like store deler og med en rekke spaltingsprodukter som vist på figuren. Ved spalting av uran-235 dannes f.eks. edelgassen krypton-94 (94Kr) og barium-139 (139Ba), som begge sender ut sekundære nøytroner som bidrar til å opprettholde kjernereaksjonen:
\(_{\; 92}^{235}U\;+\; _0^1n\; \left(nøytron\right)\; \rightarrow \; _{36}^{94}Kr\;+ _{\; 56}^{139}Ba\;+\;3\; _0^1n \)
Det produserer sekundære nøytroner med høyere energi som starter en kjedereaksjon.
Spaltbart materiale er uran-235 som utgjør ca. 0.72% av naturlig forekommende uran. Andre spaltbare isotoper er uran-233 og plutonium-239 laget i kjernereaktorer.

Italiensk-amerikanske Enrico Fermi fikk nobelprisen i fysikk i 1938 "for oppdagelsen av eksistensen av nye radioaktive grunnstoffer produsert ved nøytronstråling", samt for "kjernereaksjoner forårsaket av sakte nøytroner". Fermi deltok i utviklingen av en kjernereaktor og i Manhatten-prosjektet med utvikling av atombomber. Har gitt navn til grunnstoffet Fermium (100), kjernepartiklene fermioner, Fermilab (The Fermi National Accelerator Laboratory) og Fermi-Dirac-statistikk.
Sekundære nøytroner som blir frigitt ved spaltingen av uran (fisjonen) i reaktorkjernen blir termiske nøytroner når de bremses i kollisjoner med omgivelsene, og de kan bli fanget inn av uran-235, hvor det lages nye nøytroner, og en nukleær kjedereaksjon har startet, en selvforsynt prosess. Man trenger en kritisk masse uran-235, noen kilo. Bindingsenergien i uran-235 er ca. 7.6 MeV (millioner elektronvolt) og ved fisjon av 1 kilo uran-235 frigis energi ca. 80·1012J. Fisjonsvarmen brukes til å øke trykket i en gass som driver en elektrisk generator.
Forholdet mellom antall nøytroner i slutten av syklusen og ved starten kalles multiplikasjonsfaktoren k. Hvis k=1 er reaktoren kritisk, hvis k>1 er den superkritisk og hvis k<1 er den underkritisk. Til å regulere mengden nøytroner brukes kontrollstaver som kan inneholde bor eller kadmium, som kan føres inn og ut mellom uranstavene og på denne måten kontrollere reaktoren. Nedsmelting av kjernen kan skje ved ulykker.
Hvis man har lite uran-235 vil nøytronene unnslippe uten å sette i gang en kjedereaksjon. Hvis to subkritiske masser med uran-235 eller plutonium-239 tvinges sammen blir det en atombombe (fisjonsbombe)
Uranstavene er metallstaver med reaktorbrensel og består av uranoksid anriket med 2-4% uran-235 i glassperler Det sirkulerer kjølevæske mellom uranstavene. Sekundære nøytroner omdannes til termiske nøytroner ved vha. en moderator som vanligvis er vann. Tungtvann (deuterium), bor eller grafitt kan også brukes som moderator. Moderatoren varmes opp og brukes til å produsere damp som driver en elektrisk turbin. I en reaktor er det ikke nok rent uran eller plutonium til å sette i gang en eksplosjon. Eksempler på lettvannsreaktorer er trykkvannsreaktor og kokvannsreaktor. Brukte reaktorstaver inneholder rester av uran-235, plutonium-239 dannet fra uran-238 og en rekke radioaktive isotoper med både kort og lang halveringstid, og brukt atombrensel blir sendt til et reprosesseringsanlegg f.eks. Sellafield.
Fra kjernereaktorer og atombombeprøver blir det radioaktivt avfall i form av radioaktiv gass og væske, og noen av de radioaktive isotopene har store helsemessige konsekvenser som 131jod (131I, halveringstid 8.7 dager) som går til skjoldbruskkjertelen, strontium- 90 (90Sr, halveringstid 28.1 år) som går til beinvev og cesium-137 (137Cs, halveringstid 30 år) som fordeler seg inne i hele kroppen sammen med kalium (jfr. bl.a. natrium-kalium-pumper i overføring av nerveimpulser), og kommer bl.a. i nærkontakt med DNA og kan gi mutasjoner.
Naturlig uran inneholder 99.275% uran-238, 0.72% uran-235 og 0.005 uran-234.
I en uranfyrt formeringsreaktor (breederreaktor) lages spaltbart plutonium-239 (239Pu) fra ikke-spaltbart U-238 (halveringstid 4.5·109 år), og plutonium-239 kan benyttes til å lage atombomber og kjernefysiske våpen:
\(_{\;92}^{238}U\;+\; _0^1n\; \left(nøytron\right)\;\rightarrow\, _{\;94}^{239}Pu\;+\;2\; _{-1}^{\;0}e\;+\;2\; \overline \nu\left(antinøytrino\right)\)
Nøytronaktivering er en målemetode som kan brukes til å bestemme hvilke grunnstoffer som forekommer i en prøve ved å bruke nøytroninnfanging og deretter sendes det ut gammastråling som er spesifikk for de enkelte grunnstoffene.
Torium og toriumkraftverk
Den svenske kjemikeren Jons Jacob Berzelius oppdaget grunnstoffet og metallet torium (thorium) i 1828, og ga det navn etter den norrøne guden Tor (Thor). I Norge finnes torium i større mengder i mineralforekomster i Fensfeltet ved Ulefoss i Telemark. Rester av en kalksteinsvulkan (Fenvulkanen) fra >500 millioner år fvt., med mange bergarter som Brøgger undersøkte. Bl.a. søvitt i Søve gruver (nedlagt) til utvinning av niob. Selskapet Thor Energy har planer om å utvinne torium fra Fensfeltet til kjernekraftbrensel. Torium finnes naturlig som den radioaktive isotopen thorium-232 (232Th) med halveringstid 1.4·1010 år. I nedbrytningsseriene for torium og uran dannes det thorium 228, thorium 230 og thorium 234 en radioaktiv serie som ender i bly-208. Torium er et hvitt sølvaktig metall. I sjeldne jordarter fosfatmineralet monazit som inneholder toriumfosfat eller thoritt med ThSiO4. Thorium-232 er ikke spaltbart, men ved å absorbere nøytroner fra uran (ThO2-UO2) eller plutonium (ThO2-PuO2) blir omdannet uran-233 Men først på torium omdannes til til protaaktinium 233 (233Pa) som gir uran-233 (tilsvarende uran-238 transmuterer til plutonium-239). Det blir også produsert uran-232 som er en sterk gamma-emitter. Thoriumkjernebrensel blir brukt forsøkvsvis saltsmeltereaktorer med smeltet natrium, eller i tungtvannsreaktorer. Torium-plutonium MOX-brensel ble testet ut i Haldenreaktoren i 2013. Uran-233 kan også bli brukt i kjernevåpen.
Fusjon
I sentrum av Solen er det ca. 15 millioner grader celsius (15·106 K) og trykket (200·109 atmosfærer) og tettheten er enorm (1500·103 kg m-3). Under slike betingelser er all materien i form av plasma med frie elektroner, nøytroner, protoner og alfapartikler. I en proton-proton syklus omdannes hydrogen til helium og tapet i masse frigir kolossale mengder energi.
\(4\; _1^1H\; \rightarrow \; _2^4He \; +\; 2\; _{-1}^{\; \; 0}e\; \left( elektron\right)\; +\; 2\;\nu\; \left(nøytrino \right)\)
Det dannes 2.5·1012 J per mol alfapartikler og antinøytrinoer står for ca. 2% av energiutsendelsen fra sola. I Sola vil positroner som annihilerer med elektroner sende ut gammastråling.
I en hydrogenbombe brukes en vanlig fisjonsatombombe basert på uran eller plutonium som tennsats for å få høy nok temperatur og trykk til å starte fusjonen i hydrogenbomben.
\(_1^3H\;\left(tritium\right)\;+\; _1^2H\; \left(deuterium\right)\; \rightarrow \; _2^4He\; +\; _0^1n\; \left(nøytron\right)\)
Tokamak-reaktoren er en av fusjonsreaktorene man har prøvd. Hvis man hadde klart å konstruere en fusjonsreaktor ville menneskets energiproblem blitt løst. Det finnes deuterium i havvann og utgjør 0.015% av alt hydrogen. For å få til en fusjon må kjernene komme nær nok hverandre til at en termonukleær fusjon skal skje. Man må først fjerne elektronene rundt kjernen slik at man får dannet en elektrisk nøytral gassblanding med frie elektroner og kjerner, plasma, på samme vis som i Sola. Deretter kan tritium og deuterium fusjonere i en implosjon og danne helium.
Måleenheter for radioaktivitet
Radioaktivitet ble tidligere målt som Curie etter Marie Curie som oppdaget radium. 1 g radium har en stråling på 1Ci som er lik 3.7 1010 desintegrasjoner per sekund.

Måleenheten for radioaktiv stråling er bequerel (Bq) oppkalt etter Henri Becquerel (1852-1908). 1 bequerel tilsvarer en desintegrasjon per sekund (dps).
1Bq = 1dps
1Ci=3.7·1010 Bq.
Mengden stråling som absorberes kalt absorbert dose med enheten Gray (Gy og er lik 1joule per kg absorberende materiale.
Rad er en eldre måleenhet for absorbert dose og
1 rad=10-5 J g-1= 0.01 J kg-1
100 rad tilsvarer 1 gray. 1Gy=100 rad.
En dose med 1 gray alfastråling gir ikke samme biologiske effekt som 1 gray gammastråling, betastråling eller nøytronstråling, og måleenheten gray er derfor ikke velegnet når man skal studere biologiske effekter av stråling fra radioaktive isotoper.
For å måle biologiske effekter av strålingen brukes doseekvivalent med enheten Sievert (Sv). Doseekvialenten H = DQN hvor D er absorbert stråledose i gray, Q er et ekvivalentledd hvor Q=20 for alfastråling og Q= 1 for beta- og gammastråling. En eldre måleenhet er enheten rem (røntgen ekvivalent menneske). En røntgen (R) er mengde radioaktivitet som lager 1.6·105 ionepar.
Strålingen fra ustabile atomkjerner er ioniserende ved at det blir slått løs elektroner.
Høy betastråling og gammastråling kan registreres i et Geiger-Müller rør. Den baserer seg på et katoderør med lavt trykk. Når ioniserende stråling lager gassioner går det en strøm som forsterkes og kobles til en pulsteller med tilhørende klikking.
Geigerrøret inneholder i tillegg til katode og anode en edelgass (helium, neon eller argon) og en quencher (butan, propan, etanol) som hindrer kontinuerlig ionisasjon. En betapartikkel gjennom gasen frigir et orbital elektron fra gassen som gir et ionepar. Man kan lage en grafisk framstilling av spenning (V) mellom elektrodene på x-aksen og antall ioner på y-aksen. Etter en initialfase har denne kurven en lineær fase som er velegnet for telling av de fleste radioaktive isotoper, før kurven flater noe av i Geiger-Müllerområdet. Ved høyere spenning av røret kontinuerlig utladning
Hvis ioniserende stråling som beveger seg gjennom et tåkekammer så vil det dannes spor med kondenserte mikrodråper. Betastråling kan også måles i en scintillasjonsteller.
Radioaktivitet og planter
Radioaktivt cesium følger med kalium og radioaktivt strontium følger kalsium
Opptaket av radioaktivt cesium i planter, cesiumisotopene 134Cs (cesium-134) og 137Cs (cesium-137) med halveringstider henholdsvis 2 og 30 år, har vært ansett som et av de største miljøproblemene ved radioaktiv forurensning. Resultatet etter Tsjernobylulykken i 1986 kommer vi til å merke i minst 50 år til hos oss. Cesium bindes sterkt til de negativt ladete kolloidene aluminiumsilikat i jorda, og cesium kan over mange år gradvis gjøres tilgjengelig for plantene, spesielt i fjell og utmark hvor det er lite gjødsling og lave konsentrasjoner av kalium. Kalium og cesium hører begge med til alkalimetallene i det periodiske system, og har derved mange like kjemiske egenskaper. 90Sr (strontium-90) og plutoniumisotoper og radioaktivt jod , med kort levetid, skaper også store miljøproblemer. Strontium hører med i gruppen jordalkaliemetallene i det periodiske system. Radioaktivt strontium-90 (90Sr) med halveringstid 28.8 år vil følge opptaksproteinene for kalsium inn i plantene. Hos mennesker og dyr vil strontium lagres i beinvevet sammen med kalsium. Planter som for eksempel blåbær kan også ha et høyt innhold av ikkeradioaktivt strontium.
Jorda inneholder negativt ladete kolloider bestående av aluminiumsilikater (leirpartikler 1 -100 μm) og humussubstanser. Ioner med positiv elektrisk ladning (kationer) bindes til kolloidene. Jo større ladning kationene har desto sterkere bindes de til kolloidene. For kationer med samme ladning bindes de med minst ioneradius i hydratisert tilstand hardest. Et ion (gr. ion= vandrer) er et atom med elektrisk ladning.
Vi får følgende rekke av kationer hvor de lengst til venstre bindes hardest til kolloidene:
H+ Al3+ Zn2+ Ca2+ Mg2+ NH4+ Cs+ Rb+ K+ Na+
Vi ser at cesium bindes hardere til kolloidene enn kalium. Kalium kan bli byttet ut av alle ionene til venstre for seg i rekken over, inklusivt av cesium. Kalium utgjør 0.2 -3 % av det totale mineralinnholdet i jorda. Mesteparten (ca. 80%) foreligger bundet i krystallgitter f.eks. feltspat. Resten er bundet til leirmineraler og fritt i jordvæsken i likevekt med leirmineralene. Leirmineralene er det endelige forvitringsprodukt av silikatmineralene. De kan ha to sjikt (kaolinitt), tre (illitt, vermikulitt, montmorillonitt) eller flere sjikt (kloritt). Leirmineralene har store ytre og indre overflater og har stor evne til å binde vannmolekyler og ioner mellom sjiktene. I et land som Norge som utsettes for store mengder surt regn vil etter hvert cesium frigis fra de øverste par cm av jordlaget og vil kunne bli gjort tilgjengelig for plantene. Cesium havner også etter hvert ut i vann og vassdrag. Kalium bindes lite til organiske forbindelser i jorda, slik at de organiske kaliumreservene er små (mindre enn 0.1% K i råhumus). Radioaktivt cesium i jord og vegetasjon i våre områder stammer fra kjernevåpenprøver og ulykker ved kjernekraftverk. Få måneder etter nedfall av radioaktivt cesium minsker betydningen av avsetningen på overflatene av vegetasjonen. Større betydning får da overføringen av radioaktive nuklider fra jord til planter og transport i næringskjedene. Fysiske, kjemiske og biologiske faktorer påvirker hvor fast de radioaktive nuklidene er bundet i jorda og hvor tilgjengelig de er for plantene. Innholdet av kalium er høyt i plantene og opptak og tilgang på kalium vil ha stor betydning for opptaket av radioaktivt cesium. Radioaktivt cesium forekommer fritt i planten.
Den biologiske halveringstiden for en radioaktiv nuklide er definert som tiden det går før 50% av den radioaktive nukliden er aktivt utskilt fra det biologiske system via biologiske prosesser.
Den effektive halveringstiden er tiden som går med før 50% reduksjon i innholdet av den radioaktive nukliden uten hensyntagen til om det er ytre fysiske eller indre biologiske mekanismer for utskillelsen.
Konsentrasjonen av radioaktivt cesium varierer sterkt selv innen et lite område. Dette skyldes:
1) Mengde, type og forvitringsgrad av leirmineralene.
2) Mengden av organisk stoff i jorda.
3) Mengden av kalium og andre kationer bundet til leirmineralene.
I arktiske og alpine strøk er vekstsesongen kort, sommertemperaturen lav og nedbrytningen liten. Dette har stor betydning for den biologiske halveringstiden. Langlivete fisjonsprodukter akkumuleres derfor i alpine strøk. I sørlige og tempererte strøk vil de biologiske systemene rense seg selv ved sin aktive vekst, forutsatt at det ikke blir noen ny tilførsel av radioaktivitet. Lav og sopp viser stort opptak av radioaktivt cesium. Mykorrhiza vil ha stor betydning for opptaket av radioaktive isotoper i trær. Spesielt på sur jord blir opptaket stort. Stråledosene som plantene utsettes for er så små at det sannsynligvis ikke vil øke mutasjonsfrekvensen hos plantene. Større er den økonomiske betydningen når radioaktivt cesium i matvarer overstiger tiltaksgrensene. Deinococcus radiodurans er en ekstrem stråleresistent bakterie isolert nær atomreaktorer og andre strålekilder.
Radioaktivt teknesium, ruthenium og polonium
Teknesium (Tc) har bare ustabile isotoper og hører hjemme i mangangruppen i det periodiske system, og tas opp av plantene sannsynligvis sammen med mangan. Technesium er et av spaltningsproduktene fra atomreaktorer. Utslipp av teknesium fra gjenvinningsanlegget for brukt kjernebrensel i Sellafield i England er blitt funnet igjen i alger langs norskekysten.
Ruthenium-106 (06Ru) er en isotop som blir brukt i kreftbehandling. 106Ru har halveringstid 373.6 dager og sender ut beta-stråling og blir omdannet til palladium-106. 106Ru er et spaltingsprodukt i fisjon av uran-235 (235U) i kjernereaktorer., og er en av isotopene man registrerer etter kjernekraftulykker, sammen med jod-, xenon-, cesium- og strontium-isotoper.
Polonium-210 (210Po) har halveringstid 138.376 dager, og sender ut sterkt ioniserende alfa-stråling. Ble brukt til å ta livet av Aleksandr Litvinenko.
Atombomeprøvesprengninger på Novaja Semlja
Sovjetunionen gjennomførte en rekke atombombeprøvespreningninger på Novaja Semlja under den den kalde krigen og i rustningskappløpet med USA, på 1950 til 1960-tallet. I begynnelsen av oktober 1961 sprenger Sovjet en atombombe p 30 megatonn, tilsvarende 2500 Hiroshima-bomber. Den 24. oktober 1961 sprengte Sovjet en hydrogenbombe på 50 megatonn. USA testet sine bomber i Nevadaørkenen og ved Bikini atollet i Stillehavet. Prøvesprengninger i atomsfæren spredde radioaktivitet over hele Jordkloden. I Statens råd for strålehygiene satt bl.a. professor i kjernekjemi Alexis Pappas, professor i genetikk Per Oftedal og fysiker Arne Bull, alle fra UiO. Melkeprøver analysert ved Statens radiologiske-fysiske laboratorium viste fordelingen av radioaktivt nedfall fra sprengningene. Strontium-90 (90Sr), cesium-134 og cesium-137 (137Cs), samt den kortlivete jod-131 (131I) For beboere fra de nordelige landsdeler ble det foretatt "kroppstelling" av radioaktivitet fra nedfallet, blant annet fra radioaktivt cesium.
Fisjonsreaktorer på U-båter, hangarskip og isbrytere
Fisjonsreaktorer på hangarskip, U-båter og isbryter varmer opp vann som gir damp som via dampturbiner driver propellene eller elektrisk motor. Brenselsstaver med uranoksid anriket med fra ca. 20% U-235 opp til 96% anrikning. Når kjernen i U-235 treffes av et nøytron blir via et eksitert 236U kjernen spaltet i to deler, for eksempel fisjonsproduktene krypton-92 og barium-141, energi 177 MeV samt tre nye nøytroner som fortsetter kjernereaksjonene.
Fisjonsreaktorer i satelitter
Selv om solcellepaneler er vanlig er det flere satelitter som bruker kjernereaktorer i energiforsyningen, spesielt de som har baner langt unna Sola. For eksempel radioisotop termoelektriske generatorer (RTG) som bruker en matrise med termokoblinger som bruker varmen fra kjernereaksjoner e.g. plutonium-238-oksid (238PuO2) i Cassini til å produsere strøm via Seebeck-effekt. Plutonium-238 har halveringstid 87.7 år og er gunstig med lite gammastråling og nøytronstråling. Andre isotoper som blir brukt i satelitter er blant annet curium-244, strontium-90, polonium-210, prometium-147, cesium-137, cerium-144, rutenium-106 americium-241. Alfaemitter gir mer energi enn betaemitter. Størst risiko for radioaktiv kontaminering er hvis det skjer feil ved oppskytingen av satelitten, eller hvis den faller ned gjennom atmosfæren.
Kjernekraft og atomkraftulykker
Etter et jordskjelv med påfølgende tsunami skjedde det 11. mars 2011 en atomulykke ved kjernekraftverket Fukushima i Japan, med eksplosjoner og avkjølingsproblemer som kunne ha gitt kjernefysisk nedsmelting (ukontrollert kjedereaksjon) i av tre av atomreaktorene (lettvanns kokvannsreaktorer (BWR)). Når uranstavene blir for varme spaltes vann til hydrogen og oksygen og det kan skje en hydrogeneksplosjon. I skadeomfang kommer atomulykken Fukushima nær Tokyo på andreplass (INES7, International Nuclear and Radiological Event Scale, en skala for alvoret i atomulykker utarbeidet av Det internasjonale atomenergibyrået (IAEA)), etter Tsjernobylulykken i 1986 (INES7, som betyr alvorlig katastrofe). Atomulykken ved kjernekraftanlegget Three Mile Island i USA 1979 ble kategorisert til INES5 . Atomulykken Majak kjernkraftverk i Sovjetunionen i 1957 (INES6). Flere atomulykker ved Windscale/Sellafield i Storbritannia i perioden 1955–1979 er kategorisert til INES5-INES4. Atomulykke ved Forsmark kjernekraftverk i Sverige juli 2006 (INES2).
I trykksvannsreaktorer benyttes ofte borsyre som moderator. Vannet som ble brukt til å kjøle ned reaktorene i Fukushima ble tilsatt grunnstoffet bor (B). Bor har effektiv innfangning av nøytroner, bremser nøytronstrålingen og videre kjernereaksjoner. Har således samme funksjon som tungtvann. Det er bor i kontrollstavene som senkes mellom uranstavene for å regulere aktiviteten i kjernekraftanlegget. Noen av fisjonsproduktene i en kjernereaksjon virker som en nøytrongift med stor evne til å absorbere nøytroner, blant annet xenon-135 (fra nedbrytning av jod-135) og ikke-radioaktiv samarium-149, samt gadolinium-157. og vil til slutt bremse ned kjedereaksjonene i reaktoren. Derfor må kjernebrenselet gjennom en reprosessering for å fjerne fisjonsproduktene.
Gadoliniumnitrat (Gd(NO3)3)∙6H2O) fanger nøytroner og kan bli brukt som moderator i trykk tungtvannsreaktorer. Ved Tsjernobylulykken i 1986 ble reaktoren dekket av sand som smeltet, og det ble brukt gadoliniumnitrat for å redusere nøytronstrålingen fra reaktoren. Nå er reaktoren dekket av en sarkofag med betong og stål, men allikevel har man oppdaget en økning i nøytronstråling fra reaktoren.
I mange land, blant annet USA, Frankrike, Kina, Russland og Sør-Korea er kjernekraft en viktig energikilde.
Norge er i heldige stilling og selvforsynt med vannkraft hvis den brukes riktig og ikke eksporteres. Allikevel er det noen som lefler med tanken med at også Norge bør satse på atomkraft, uten å ha lært noe som helst fra Halden-reaktoren og de enome kostnadene ved nuklær dekommisjonering i avviklingen av atomanlegg og atomopprydding, og et uløst problem med lagring av høyaktivt avfall som er radioaktivt i millioner av år. For Haldenreaktoren er det anslått 50 års arbeid med dekommisjonering og opprydding og kostnad 21 milliarder
Oppbevaring av norsk radioaktivt avfall
Norge har store lagre med radioaktivt avfall fra atomreaktorene i Halden og på Kjeller. Mye av dette er lagret i i nærheten av tettbefolkete områder i Oslo-regionen.
Etter at dette ble skrevet:
I juni 2018 fattet styret i den selvstendige stiftelsen Institutt for energiteknikk (IFE) et fornuftig vedtak om nedleggelse av tungtvannsreaktoren i Halden som hadde vært i drift siden 1959. Riktignok etter at Regjeringen ved "en glipp" hadde sendt ut en pressmelding om at Haldenreaktoren skulle nedlegges. Det kommer imidlertid til å ta mange tiår innen Haldenreaktoren er demontert, med kostnad milliarder av kroner. Jfr. erfaringen fra demonteringen av atomreaktoren i Risø (DR3), Danmark, som ble stengt i år 2000. Kjernekraftverket Barsebäck 2 i Skåne i Sverige, som ligger like ved København, ble stengt i 2005. Demonteringen av Barsebäck-reaktoren er tenkt startet i 2023 og vil vare i minst 7 år.
Kjernekraftverk produserer store mengder høyaktivt, mellomaktivt og lavaktivt radioaktivt avfall.
I Aftenposten 30. oktober 2018 kan man lese overskriften på førstesiden:
Tvil om atomsikkerhet. Statens strålevern slår alarm og sikkerheten rundt lagring av atomavfall i deponiet i Aurskog-Høland kommune, der alvorlige brudd på konsesjonsbetingelsene er avdekket.
Atomdeponiet i Himdalen (ikke langt fra Lillestrøm og Oslo), er Norges deponi for lav- og mellomaktivt atomavfall, startet i 1998 og skal ta imot avfall til 2030. Deretter skal avfallsanlegget være under administrativ overvåking i 300-500 år (Aftenposten 30.10.2018).
Det ble blant annet funnet tønner med for mye americium-241 (241Am), halveringstid 432.2 år
Tenk over det:
300-500 år fra nå, og det et atomlager for mellomaktivt og lavaktivt radioaktivt avfall. Anta ca. 30 år per generasjoner, det vil si 10 generasjoner framover i tid. Hva vet du om dine forfedre 10 generasjoner tilbake i tid ?
I Norge er det egentlig bare Bellona med Frederik Hauge og atomfysiker Nils Bøhmer i spissen som har stått på barrikadene, nokså alene.
Og hva med det langlivete høyaktive radioaktive avfallet fra brukt reaktorbrensel ?
Uran-235 (235U, halveringstid 703.8 millioner år), plutonium-239 (239Pu, halveringstid 24110 år), neptunium-237 (237Np, halveringstid 2.14 millioner år), og andre. Ingen har funnet en varig lagringsform. Det fungerer ikke når avfallet blir støpt inn i glass og glasset sprekker på grunn av den intense radioaktive strålingene, eller når isotoper løst i syre innstøpt i betong forvitrer. Langlevete isotoper i borstål med kobberkapsel er heller ikke godt nok.
Nå er det snakk om et lager som det må holdes kontroll på i hundretusen år (100 000 år) eller mer. Slike atomlagre for høyaktivt radioaktivt avfall er sannsynligvis det eneste som kommer til å stå igjen etter vår tids sivilisasjon. Hvordan skal man semantisk merke en advarsel i et slik anlegg hvis et menneske, hvis noe slikt fremdeles finnes om noen tusen år, uforvarende skulle komme inn i atomlageret og skjønne at du beveger deg inn i et livsfarlig område med gammastråling ? De egyptiske pyramidene er ca. 4500 år gamle, Stonehenge ca. 5000 år.
På halvøya Olkiluoto ved Østersjøen, hvor det også ligger et kjernekraftverk, bygger Finland i nærheten, ved Onkalo, det første lageret for høyaktivt avfall i stabilt granittfjell, 500 meter under bakken (Onkalo spent nuclear fuel repository). Et lager med hudretusenårs perspektiv.
Når det snakkes i panegyriske vendinger om et thoriumatomkraftverk og "Norges nye energieventyr", med thorium fra Fensfeltet i Telemark, blir man unektelig noe betenkt.
Våre myndigheter: Helsedirektoratet, Statens strålevern, Statens legemiddelverk har 24. april 2018 laget en brosjyre: Jodtabletter ved atomhendelser, og med ønske om at vi alle bør ha jodtabletter lett tilgjengelig i heimen. Hvilke signaler gir dette til befolkningen om tingenes tilstand ?
Atombomben
Albert Einstein (1879-1955), berømt for den spesielle relativitetsteori, den generelle relerelativitetsteori, studier av Brownske bevegelser og forklaringen av den fotoelektriske effekten, la med ligningen E=mc2 som et tillegg til Zur Elektrodynamik bewegter Körper det teoretiske grunnlaget for atombomben. Masse er energi. Like lite som Nobel kan klandres for militær bruk av dynamitt og sprengstoff, kan Einstein klandres for generalenes ønsker.
Otto Hahn (1879-1968), Lise Meitner (1878-1968)og Fritz Strassmann (1902-1980) oppdaget i 1938 at det var mulig å spalte tunge atomkjerner (uran) ved å bombardere dem med kjernepartikler (nøytroner), det var mulig å få til fisjon av uran-235 hvor et av fisjonsproduktene var varium Nøytroner kunne styrtes inn i atomkjernen og gi fisjon. Lise Meitner skjønte rekkevidden av atomspaltingen, men var jøde og måtte flykte fraNazi-Tyskland i 1938, n\mens Hahn fikk nobelprisen i kjemi i 1944, hvor Lise Meitner ble tilsidesatt. Lise Meitner har fått sin oppreisning ved grunnstoff 109 heter meinerium Allerede Ernest Rutherford og Frederick Soddy hadde i 1903 beregnet av det ville frigis store energimengder ved en fisjonsprosess , nærmere kalkulert avOtto Robert Frisch i 1939. Italieneren Enrico Fermi (1901-1954) utviklet en teori for betastråling. Fermi påpekte bruken av langsomme nøytroner som lettere kunne reagere med kjernene, og han var sammen med Leo Szilard med å konstruere verdens første kunstige kjernereaktoren (atomreaktor), ved universitetet i Chicago i 1942. Frederic Joliot hadde funnet muligheten for å bremse nøytronene med moderatorer, grafitt eller tungtvann. Naturlig uran inneholder bare ca. 0.71 % uran-235 og resten uran-238. Det store spørsmålet var hvor stor var den kritiske massen ? Uran-235 kan bli anriket ved sentrifugering, det trengs ca. 15 kilo U-235. Plutonium-239 laget i atomreaktor var mer effektivt, det trengtes bare en kritisk masse 4 kilo. Manhatten-prosjektet ved Los Alamos i New Mexico ble ledet av Robert Oppenheimer (1904-1967) førte til utviklingen av en fisjonsbombe.16. juli 1945 skjedde den første prøveeksplosjon av en atombombe kalt Trinity. Verden ble ikke lenger den samme. En kritisk masse med anriket uran U-235 treffes av nøytroner som blir absorbert og gir en ustabil kjerne som deles i ca. to halvdeler, hvor det samtidig frigis store mengder energi. Det sendes samtidig ut 2-3 nye nøytroner og det blir en kjernereaksjon. Den 6. august 1945 ble det over Hiroshima sluppet en atombombe av kanonrørtypen med to underkritiske masser U-235 som skytes mot hverandre, sammen med beryllium og polonium som gir nok nøytroner til å lage en eksplosiv spalting av uran. Et lysglimt, trykkbølgen, massive ødeleggelser og død, og den soppformete atomskyen. Over Nagasaki ble det 9. august sluppet en implosjonsbombe basert på plutonium-239. Ukrainskamerianske fysikalskkjemiker George Kistiakowsky (1900-1982) hadde ansvaret for utvikling av synkroniserte eksplosive linser inn til plutoniumkjernen for å lage en implosjon. For eksempel HMX (oktogen, 1,3,5,7-tetranitro-1,3,5,7-tetrazokan) som er et eksplosivt monoamin med fire nitrogenatomer i åtte-ringen med alternerende karbon og nitrogen, med fire nitrogrupper -N+O2- festet til hvert nitrogen. Tilsvarene for RDX (Research Department eXplosive") et heksogen3 1,3,5-trinitro-1,3,5-triazinan, seksring med alternerende karbon og nitrogen blandet med TNT (trinitrotoluen). Baratrik (TNT-bariumnitrat). Norsk Hydro produserte vikke bare tungtvann som brukt til å regulere nøytronstrålingen i kjernereaktorer, men også nitrat brukt for å lage sprengstoff og våpenammunisjon.
Igor Kurtsjatov ledet Sovjetunionens atombombeprogram og prøvesprengningene skjedde i Semipalatinsk i Kasakhstan og på Novaya Zemlya. Storbritannia sprengte mellom 1956 og 1963 atombomber ved Maralinga ved den store Victoriaørkenen i Sør-Australia, Montebello Island ved NØ-Australia, samt øya Kiritimati i Stillehavet. Franikrike i 1960-61 ved Reggene i Sahararegionen Algerie, med kodenavn Gerboise, navn på en ørkenrotte Allactaga tetradactyla.. Prøvesprengningene ga soppformete skyer som steg opp og økt mengde radioaktivitet i atmosfæren, avsatt via nedbør.
I arbeidet med den ennå kraftiger hydrogenbomben deltok Edward Teller (1908-) og Johan Archibald Wheeler (1911-). Wheeler og Bohr utviklet i 1939 en teori for fisjon grunnlagt på en dråpemodell for atomkjernen.
Utviklingen i USA av en termonukelær hydrogenbombe ble ledet av Edvard Teller og Stanislaw Ulam, tilsvarende Andrey Sakahrov i Sovjetunionen. En fisjonsbombe ble brukt som tennsats som sendte ut røntgenstråling som skapte en strålingsimplosjon som startet fusjonen av deuterium. USA sprengte sin første Teller-Ulam hydrogenbombe Ivy Mike på Enewetak atollet i Stillehavet 1. november 1952. En 15 megatonns hydrogenbombe ble sprent på Bikiniatollet 26 mars 1954.
30 oktober 1961 sprengte USSR en 50 megatonn hydrogenbombe (Tsar Bomba) ved Novaya Zemlya, den største som noen gang er sprengt.
Flere fysikere, bl.a. Robert Oppenheimer protesterte og mente at kjernekraften burde brukes til fredelige formål i stedet. Teaterstykket Copenhagen tar for seg et møte mellom Niels Bohr og Werner Heisenberg (1901-1976).
Arten menneske hadde utviklet et våpen som kunne utslette store deler av livet på Jorden. Murrey Gell-Mann kunne holde orden på alle partiklene som kom ut av partikkelakselleratorene. Atombombene har gitt en gjensidig trussel og terrorbalanse.
Koboltbombe med formål å kontaminere med radioaktivitet Fysikeren Leo Szilard introduserte i 1950 en slik «skitten» termonukleærbombe omgitt av kobolt-60 som transmuterer under eksplosjonen og vil kontaminere store områder med radioaktivitet slik at det blir ubeboelige for mennesker for lang tid, kobolt-60 med halveringstid 5.27 år.
En nøytronbombe (ERW) har til formål å produser mest mulig dødelig nøytronstråling i nærheten av eksplosjonsstedet.
Når en nasjon har etablert et kjernekjemisk fagmiljø i produksjon av kjernekraft med kunnskap om reaktorbrensel, er det ikke veldig lang vei før en nasjon styrt av en diktator eller teokrat kan starte sentrifuger og anrikning av spaltebart materiale med produksjon av kjernevåpen.
Who's next ? (tekst og musikk Tom Lehrer)
First we got the bomb and that was good 'cause we love peace and motherhood. then Russia got the bomb, but that's okay .-'cause the balance of powers's maintained that way. Who's Next ? Then France got the bomb but don't you grieve, 'cause they're on our side (I believe).- China got the bomb but have no fears .-'cause they can't wipe us out for at least five years. Who's next ?....Se Youtube.
Hør og se gjerne også andre sanger med Tom Lehrer: Wernher von Braun og We will all go together when we go.
Alle fra tiden med slagord: Bedre aktiv i dag, enn radioaktiv i morgen. Atomkraft - nei takk. En tid hvor Ole Andreas Kopreitan (1937-2011) var leder av Nei til atomvåpen, og mange i vår generasjon husker Kopreitan i Karl Johansgate med ei barnevogn fylt med buttons og informasjonsmateriell. Han fikk Zola-prisen i 2002.
Fysikeren Gunnar Randers og Odd Dahl var viktige i byggingen av forsøksreaktoren JEEP 1 (Joint Establishment Experimental Pile) på Kjeller som åpnet i 1951, hvor Norsk Hydro bidro med tungtvann, men hvordan skaffe uran ? Evje i Setesdal var en mulighet, uran-tungtvannsbytte med Frankrike en annen, men endte med uran fra Kongo. Les mer om dette i Olav Njølstad sin utmerkede gode biografi om Jens Christian Hauge. (Aschehoug 2012). Anbefales meget sterkt for dem som er interessert i norsk etterkrigshistorie.
The China Syndrome (Kinasyndromet) , regi James Ridges, amerikansk film fra 1979 om en tenkt kjernekraftulykke. .
Svindel og forskningsjuks ved forskningsreaktoren i Halden
Det helt utrolige har etter hvert blitt kjent at det har foregått forskningsmanipulasjon og forskningsjuks innen atom- og fysikkmiljøet knyttet til forskningsreaktoren i Halden. Enhver tillitt til forskningsmiljøet tilknyttet atomkraft i Norge har totalt forsvunnet.
NRK har som vanlig gjort en glitrende god og prisverdig jobb med å finne ut hva som har skjedd, denne gang ved journalist Odd Isungset + 5 til:
Slik lurte norske atomforskere verden (22. november 2020)
Slik lurte norske atomforskerne verden (nrk.no)
Denne bør være obligatorisk lesestoff for all ungdom, og alle politikere i kommuner, fylke og Stortinget. Se nrk.no
Aksjon mot Atomkraft
Harald Wergeland (1912-1987), professor i teoretisk fysikk ved NTH fra 1936 med forskning innen eksperimentell kjernefysikk var også aktivt med i Aksjon mot Atomkraft stiftet i 1974 etter at NVE planla et atomkraftverk i Norge i 1973 basert på Stortingsmelding 97 (1969-1970). Wergeland var også skeptisk til bygging av Haldenreaktoren og Gunnar Randers planer om Norge som atommakt. Når man i ettertid ser på kostnadene ved demontering og dekommisjonering av Haldenreaktoren og fjerning av brukt reaktorbrensel så fikk Wergeland rett i sin skepsis. I en atomreaktor kokes vann til vanndamp, varmetapet er stort (Carnot) og miljøkonsekvensene meget store. I den pågående debatten om CO2 vitner de gjenoppvekkete planene om atomkraftverk i Norge som usedvanlig naive og lite kunnskapsbaserte.
Litteratur
Wikipedia
Gunnar Randers: Lysår (Gyldendal 1975)