Enzymer virker som katalysatorer når karbon-karbon-bindinger skal lages eller brytes, og det er likhetstrekk i i både hvordan bindinger dannes og brytes. I tillegg til bindinger deltar enzymer deltar i overføring og forflytning av kjemiske grupper innen (indre omvandling) og mellom molekyler. Noen av reaksjonene er reduksjons-oksidasjonsreaksjoner, og noen involverer fri-radikal reaksjoner.
Hydrogenbindinger, van der Waals bindinger og dipol-dipolbindinger er svake bindinger. Elektroner som inngår i bindinger kan vises som punkter eller prikker mellom atomer (Lewis-prikker), eksempel molekylært hydrogen (H:H), eller bindingen kan angis med en strek, for eksempel etanol (CH3-CH2-OH) .
I en kjemisk reaksjon skjer det regruppering av atomer og molekyler og det blir dannet nye kjemiske forbindelser. En kjemisk reaksjon blir påvirket av energi i form av varme, lys eller høyfrekvent lyd. Den tyske kjemikeren Manfred Eigen (1927-2019) fikk nobelprisen i kjemi i 1967 sammen med Ronald GW Norrish og George Porter «for deres studier av ekstremt raske kjemiske reaksjoner, påvirket ved å forstyrre likevekten med meget korte pulser med energi».
Kovalent binding og ionebinding
Atomer kan reagere med hverandre på to måter, enten ved å dele elektroner med hverandre i en elektronparbinding (kovalent binding) eller ved å overføre ett eller flere elektroner fra ett atom til det andre (ionebinding). Stoffer som deler elektroner kalles molekyler. Stoffer som danner elektriske ladete partikler kalles ioner. Molekyler kan være satt sammen av to eller flere atomer, og molekylet kan beskrives med en molekylformel. Grunnstoffer som kan reagere med hydrogen kalles hydrider. Oksygen kan reagere med ikke-metaller og danne oksider, f.eks. nitrogen- og svoveloksider. Karbon har egenskapen at det kan danne sterk binding med seg selv og med oksygen, hydrogen og nitrogen, noe som danner grunnlaget for organisk kjemi - livets kjemi. Hydrokarboner er bindinger mellom karbon og hydrogen (CnH2n+2), hvor n er et helt tall. For n opptil 6 kalles disse alkaner, og disse finnes i naturgass f.eks. metan, etan, propan og butan.
Oktettregelen sier at når atomer inngår i kovalent binding så forsøker de å dele elektroner slik at det ytre skallet får 8 elektroner.
I organiske molekyler kan et hydrogen erstattes med en hydroksylgruppe og danne alkoholer, f.eks. metanol (CH3OH) og etanol (C2H5OH). Alkoholer er organiske molekyler som har en hydroksylgruppe (-OH) festet til et karbontetraeder.
Metaller kan binde seg til ikke-metaller og danne en ionebinding f.eks. natriumklorid (NaCl). Positivt ladete ioner kalles kationer. Negativt ladete ioner kalles anioner. Anioner dannes fra ikke-metaller når de inngår i ionebinding med metaller. Stoffer er elektrisk nøytrale hvis det er like mange positive som negative ladninger. På lik linje med atomene som har atommasse så har molekyler en molekylmasse. For ioner kan begrepet formelmasse brukes.
Når to forskjellige atomer inngår i binding kan en av kjernene trekke sterkere på elektronene i en binding enn det andre, noe som gir en ujevn fordeling av elektrontettheten i bindingen, og en polar binding. Vann (H20) og saltsyre (HCl) er to eksempler på polare bindinger.
Elektronegativitet er et mål på hvor sterkt et atom trekker på elektronene i en binding. Oksygen og nitrogen har høy elektronegativitet, sammenlignet med andre atomer. Størrelsen på elektronegativiteten er høyest i toppen av en gruppe i periodesystemet og øker mot høyre i en rad, og følger således samme trend som ionisasjonsenergi.
En Lewis struktur er en måte å sette opp hvilke atomer som er bundet til hvilke. Man teller opp antall valenselektroner og plasserer to i hver binding. Oktetter fylles ved å tilføre elektroner i par, og hvis sentralatomet ikke har en oktett kan det lages dobbel- eller trippelbindinger. Noen ganger blir det umulig å tegne en Lewis struktur, og man fordeler da elektroner i resonansstrukturer. F.eks. har NO3- tre forskjellige resonansstrukturer. Benzen er også en resonansstruktur hvor resonansstrukturen er indikert med en ring i midten av molekylet. Bindingsenergi angir mengden som trengs for å brte et mol bindinger. Bindingsenergien for en C-C, C=C og en C-C-trippellbinding er henholdsvis 348, 615 og 812 kJ mol-1. Lengden på en C-C- binding er ca. 0.154 nm.
I kovalente bindinger deles elektronene mellom atomene som deltar i bindingen. Ved heterolytisk bryting av en kovalent binding er det ett eller flere atomer som beholder bindingselektronene. Ved homolytisk bryting og spalting av kovalente bindinger deles elektronene mellom atomene som atskilles (• angir et uparet elektron). Et karbonatom har fire bindinger.
-C-H → -C• + •H
Det kan dannes karbonkationer som kortlivete intermediater eller mellomprodukter:
-C-C → -C• + C•
Et karbanion (C:-) og et proton (H+). Et karbanion har tre bindinger og danner et anion.
-C-H → -C:- + H+
Et karbokation (C•) og et hydrid (H:) dss. hydridanion (H-).
-C-H → -C•+ + H: (H-)
Et karbonanion og et karbokation:
-C-C → C:- + C+
To hydrogenatomer danner elektronparbinding i gassen hydrogen (H2):
H• + H•→ H:H
I karbonmonoksid (CO) er det 10 valenselektroner plassert i par (:C:::O: eller :C≡O:).
Atomorbitaler og molekylorbitaler
Hvilken tredimensjonal form et molekyl får beregnes ut fra hvordan valenselektronene plasseres seg slik at frastøtningen mellom dem blir minst mulig. Mulige tredimensjonale former er et lineært molekyl (2 elektronpar), en trekant i ett plan (3 elektronpar), et tetraeter (4 elektronpar), en trekantet pyramide (5 elektronpar) eller et oktaeder (6 elektronpar). Krystaller med NaCl er kubiske (steinsalt), og ionene danner et kubisk krystallgitter. Fasesentrerte krystaller har like partikler i hvert hjørne pluss en i senter på hver flate i kubusen. En kroppssentrert kubus har en i hvert hjørne og en i midten av kubusen. Orbitaler kan hybridisere, f.eks. kan s og p orbitaler danne sp orbitaler. Jo mer to orbitaler overlapper hverandre, desto sterkere binding er det mellom dem. Hvis 3 p orbitaler hybridiseres med en s orbital dannes det en sp3orbital.
I vannmolekylet vil sp3orbitalet til oksygen overlappe med 1s orbitalene til hydrogen. Den type binding hvor elektrontettheten er størst på en linje mellom to kjerner, dannet fra overlappende s orbitaler, p orbitaler eller hybrider mellom dem kalles sigmabinding (\(\sigma\)-binding). Hvis to p orbitaler overlapper sideveis, istedet for ende mot ende, blir elektronene konsentrert som to pølser på hver sin side av bindingsaksen mellom de to kjernene. Denne type kalles pibinding (\(\pi-\)binding) f.eks. i karbon-karbon dobbeltbindinger (C=C) eller trippelbindinger. En dobbelbinding består vanligvis en en sigmabinding og en pibinding.
På samme måte som et atom har atomorbitaler har et molekyl molekylorbitaler. Et par med 1s orbitaler som kombineres i et molekyl vil gi to molekylorbitaler: en bindende molekylorbital (sigma 1s) hvor elektrontettheten er størst mellom kjernene, og en antibindende orbital (sigma 1s stjerne( 1s*)) hvor det er minst elektrontetthet mellom kjerne som gjør at kjernene kan frastøte hverandre. Et antibindende molekylorbital angir sannsynlighetstettheten for å påtreffe elektroner som ikke befinner seg mellom de to kjernenei bindingen. Bindende molekylorbitaler angir sannsynlighettettheten for elektroner befinner seg mellom de to kjernene. Molekyler med likt antall bindende og antibindende orbitaler er utstabile. 2s orbitaler overlapper og danner sigma 2\(\sigma\) og sigma 2\(\sigma\) * molekylorbitaler.
Molekylorbitalene som dannes ved overlappende p-orbitaler er 2 sigma px orbitaler (bindende sigma 2px og antibindende sigma 2px*). Oksygen er paramagnetisk og inneholder 2 uparrede elektroner. Pielektroner i molekylorbitaler behøver ikke befinne seg fast mellom to kjerner, men kan flytte seg, såkalte delokaliserte elektroner. Delokaliserte elektroner gir ekstra stabilitet til molekylet.
Metaller inngår i ionebinding, spesielt alkalimetallene, men transisjonsmetallene kan i tillegg oppføre seg Lewissyrer og danne komplekse ioner. Cu2+ løst i vann binder seg til 4 vannmolekyler som virker som Lewisbase (elektrondonor), og avgir elektroner til Cu2+ og danner Cu (H2O)42+ med koordinasjonstall 4. Ligander er nøytrale eller anioner som virker som Lewisbaser og kan binde metallioner.
Chelater og såpe
EDTA (etylendiamin tetraeddiksyre) med anionet EDTA4- , og oksalat er eksempler på ligander som virker som chelat (gr. chele - klo), og har to klør som det kan gripe metaller med. EDTA brukes i næringsmiddelindustri og finnes i vaskemidler. I disse tilfellene brukes kalsiumdinatrium- EDTA for at EDTA ikke skal trekke ut kalsium. EDTA binder metaller bl.a. jern og kobber, som ellers vil bidra til oksidasjon av fettsyrer. EDTA finnes i sjampo for å bløtgjøre vann, hvor det binder kalsium, magnesium og jern.
Hardt vann er grunnvann som inneholder mye av Ca2+, Fe3+, Fe2+, og Mg2+ som kan felle ut såpe. Såpe (detergenter) består av natriumsalter fra fettsyrer, f.eks. stearinsyre, og bindingen mellom fettsyrer og ionene i vannet ødelegger såpens egenskaper. En måte å fjerne ioner fra det harde vannet er å tilføre vaskesode Na2CO3 10H20 slik at Ca2+ felles ut som kalsiumkarbonat (CaCO3). Et annet problem med hardt vann er at hvis vannet inneholder mye bikarbonat (HCO3-) så felles det ut karbonater på innsiden av vannrør (kjelestein). EDTA kan også fjerne ioner ved metallforgiftning. I næringsløsninger for planter brukes EDTA eller sitronsyre (sitrat) for å kompleksbinde jern. I porfyrinkjernen i klorofyll og hem virker 4 nitrogenatomer som elektrondonor til henholdsvis magnesium (Mg2+) og jern (Fe2+) som er chelatert i midten av ringen, katalysert av enzymet chelatase. Magnesium og jern kan fjernes fra tetrapyrolringen katalysert av en dechelatase. I vitamin B12 avgir 4 nitrogenatomer elektroner til kobolt i kjernen.
Ledere, halvledere og isolatorer
Metaller kan lede elektroner, og i faste stoffer er det energibånd bestående av tett sammensatte energinivåer dannet ved å kombinere atomorbitaler med lik energi fra hvert av atomene i metallet. Båndet som inneholder valenselektronene kalles valensbåndet. Alle bånd som er ledige eller delvis fylt med elektroner og som går kontinuerlig gjennom metallet kalles konduksjonsbånd. Elektroner kan bevege seg i konduksjonsbåndet. Isolerende stoffer (isolatorer) har alle valenselektronene i binding slik at valensbåndet er fylt. Det er i tillegg et båndgap mellom valensbåndet og det nærmeste konduksjonsbåndet. Elektroner kan derfor ikke komme opp i konduksjonsbåndet.
Silisium og germanium er halvledere hvor valensbåndet er fylt med elektroner, men det er kort avstand til nærmeste konduksjonsbånd. Når temperaturen på en halvleder øker så øker den elektriske ledningsevnen fordi den økte energien gir elektroner mulighet til å bevege seg opp i konduksjonsbåndet. Ved kontrollert tilførsel av urenheter til halvledere har det vært mulig å utvikle transistorer, en forutsetning for datamaskiner og forbrukerelektronikk (TV, CD- spillere, lommekalkulator). I silisium er alle valenselektronene opptatt i kovalent binding. Tilførsel av grunnstoffer i gruppe 13 f.eks bor erstatter silisiumatomer (silisium dopet med bor). Siden bor bare har 3 valenselektroner vil en av de kovalente bindingene mangle ett elektron. Når det settes på spenning kan et ledig elektron i nærheten fylle denne mangelen, men etterlader seg et positivt hull. Dette positive hullet kan fylles på nytt med et elektron osv. slik at denne positive ladningen flytter seg gjennom halvlederen. Siden det er positive ladninger som flytter seg kalles de type p-halvledere. Hvis det tilføres grunnstoffer fra gruppe 15 til silisium f.eks. arsen, som har ett ekstra valenselektron sammenlignet med silisium, vil det være et elektron til overs. Dette elektronet kan gå over i konduksjonsbåndet hvis det settes under spenning. Den bevegelige ladningen er negativ, og denne type halvledere kalles n-type halvledere. I et solcellepanel er det et lag med p-type halvleder (silisium dopet med bor) plassert over et tynt lag med silisium dopet med arsen (n-type halvleder). Når lys treffer overflaten er det ikke lenger likevekt og elektroner fanget i p-laget kan gå tilbake til n-laget. Elektroner i n-laget kan gå ut gjennom i en ledning i en elektrisk krets.
Elektrisk ledning
Når elektroner beveger seg i et metall f.eks. kobberledning, er det en motstand som hindrer elektronene, og denne motstanden gjør at en del av elektronenes energi omformes til varme. For å redusere dette energitapet transporteres strøm over lange avstander med svært høy spenning. På samme måte som mekanisk friksjon hindrer objekter å flytte seg, kan elektroners forflytning hindres. Hvis metaller eller metallegeringer kjøles ned mot det absolutte nullpunkt blir de superledende. Den nederlandske fysikeren H. Kamerlingh-Onnes fikk nobelprisen i fysikk i 1913 for å ha oppdaget de superledende egenskapene ved kvikksølv ved 4.1K. En legering med niobium og germanium (Nb3Ge) var superledende ved 23.2K. I 1987 fikk K.A. Müller og J.G. Bednorz nobelprisen i fysikk for oppdagelsen av en supraledende legering (LaBa2CuO4) ved 30 K. Det er seinere blitt laget superledende keramer.
Det har vært omdiskutert om elektriske felter fra høyspentlinjer kan gi fysiologiske effekter. En oscillerende strøm med en frekvens sender ut svak stråling med samme frekvens. Det er på denne måten radio- og TV-stasjoner sender signaler ved å pulse en elektrisk strøm gjennom en senderantenne. Vanlig elektrisk husholdningsstrøm har frekvens på 50 Hz, og strømledningene sender ut meget svak elektromagnetisk stråling, så svak at den ikke kan påvirke bindinger i molekyler.
Syrer og baser
Når vi har vann som løsningsmiddel skriver vi hydrogenion (H+) istedet for hydroniumionet (H3O+). Ifølge Arrhenius vil en syre avgi hydrogenioner (H+) i vann, og baser avgir hydroksylioner (OH-) i vann, og nøytralisering skjer mellom disse, og danner vann. Imidlertid er dette et for snevert begrep siden det finnes nøytralisering hvor et proton (H+) og hydroksylion (OH-) ikke inngår. Lewis innførte et annet syre- og basebegrep: en syre er en elektronparakseptor og base er en elektronpardonor. Den danske kjemikeren Johannes Brønsted (1879-1947) kom med følgende definisjon: en syre er en protondonor, og en base er en protonakseptor. F.eks. vil eddiksyre i reaksjon med vann danne et konjugert par hvor eddiksyre CH3COOH er en syre og CH3COO- (acetat) er en base. På samme vis blir det følgende konjugerte par hvor vann (H2O) blir en base og hydroniumionet (H3O+) blir en syre. Stoffer som kan både være en syre og base kalles amfotære (gr. amphotere - - på begge måter), dvs. amfotære stoffer kan være enten protondonor eller protonakseptor. Ammoniakk (NH3) er en base og ammonium (NH4+) er en syre. Syre-baseindikatorer er fargestoffer som skifter farge avhengig av pH.
Sterke syrer er fullstendig ionisert i vann. Svake syrer er ikke fullstendig ionisert i vann, og er ikke så sterke protondonerer sammenlignet med sterke syrer. Eddiksyre (CH3COOH), karbonsyre H2CO3) og blåsyre (HCN) er eksempeler på svake syrer. Saltsyre (HCl), svovelsyre (H2SO4) og salpetersyre (HNO3) er sterk syrer.
Kalsiumoksid (CaO) er et basisk anhydrid som bl.a. finnes i sement og i reaksjon med vann skjer følgende reaksjon og danner kalsiumhydroksid (Ca(OH)2):
![]()
Kreftene mellom ioner og vannmolekyler kan være sterk, og gjør at ioner kan bestå som faste hydrater f.eks. kobbersulfat med 5 krystallvann (CuSO4 5H2O=
Treverdig aluminium (Al3+)har nok ladning til å binde til seg vann, og gjør at dette hydratet kan bli en protondonor. Al3+ ved lav pH er giftig for planterøtter
![]()
Reduksjons-oksidasjonsreaksjoner - redoks
Reduksjons-oksidasjonsreaksjoner gir endringer i oksidasjonstall. Ifølge en kjemiker blir ved en oksidasjon oksidasjonstallet mer positivt (mindre negativt). Ved en reduksjon blir oksidasjonstallet mindre positivt (mer negativt). Syrer kan reagere med metaller, f.eks. svovelsyre fra et bilbatteri gir rust. Vanligvis er en slik reaksjon mellom syre og metall en redoksreaksjon hvor metallet blir oksidert og syren blir redusert. Når syre reagerer med zink (Zn) på en galvanisert spiker skjer følgende reaksjon:
![]()
Zink (Zn) blir oksidert til Zn2+, og 2H+ blir redusert til hydrogengass (H2). H+ virker som et oksidasjonsmiddel. Sammenlignet med salpetersyre (HNO3) som er en sterkt oksiderende syre kalles svovelsyre (H2SO4)og saltsyre (HCl) for ikke-oksiderende syrer. Slipper man en kobbermynt i konsentrert salpetersyre blir det en voldsom reaksjon og det dannes en brunfarget sky av giftig nitrogendioksid (NO2).
![]()
Kobber (Cu) blir oksidert til Cu2+, og nitrat (NO3-) blir redusert til NO2. Bruker man imidlertid en svak salpetersyreløsningen blir ikke sluttproduktet nitrogendioksid, men derimot nitrogenmonoksid (NO). Salpetersyre oksiderer også organiske stoffer svært godt, og gir derfor alvorlige hudskader hvis det søles på huden.
Dyppes metallisk zink i en løsning med kobbersulfat (CuSO4) blir zinkmetallet brunfarget av metallisk kobber:
![]()
Zink reduserer kobberioner til metallisk kobber, og kopperioner oksiderer metallisk zink (Zn) til zinkioner (Zn2+). Derimot skjer det ingen reaksjon om metallisk kobber dyppes i en løsning med zinksulfat (ZnSO4). Metallisk natrium reagerer kraftig med vann hvor vann blir redusert til hydrogengass og natrium (Na) blir oksidert iil Na+.
Forbrenning
Lavoisier oppdaget at forbrenning var en reaksjon mellom trevirke eller kull og oksygen i lufta. Oksidasjon betyr en reaksjon mellom en reaktant og oksygen, men seinere oppdaget man at dette var bare en av mange typer oksidasjon. Oksygen er et aktivt oksidasjonmiddel. Forbrenning kan skje raskt hvor både lys og varme avgis. Fossilt brennstoff inneholder karbon og hydrogen. Einsteins ligning kobler sammen masse og energi. Når metan (CH4) forbrenner frigis det energi, bindingsenergi frigis, og det skjer et mikromikrotap av masse. Reaksjonsproduktene er karbondioksid og vann:
![]()
Er det dårlig oksygentilgang blir forbrenningen ufullstendig, og det dannes giftig karbonmonoksid (CO). CO er giftig fordi det binder seg til og blokkerer det siste enzymet i respirasjonskjeden, cytokrom oksidase:
![]()
Hvis det er svært dårlig oksygentilgang dannes det rent karbon i form av sot (karbon, C):
![]()
Trekull lages ved ufullstendig forbrenning av ved. Hvis fossilt brennstoff innholder svovel vil det i tillegg dannes svoveldioksid (SO2).
Metaller kan også forbrenne. I gamle dager brukt man blitzpærer med magnesiumtråder, og ble det sendt strøm inn i trådene ble det varmt nok til at det tente og lyste opp i et kort glimt. Generelt reagerer metaller sakte med oksygen i en reaksjon som kalles korrosjon. Jern oksideres til rust Fe2O3 xH2O.
Kull til grilling må bare brukes utendørs hvor det er nok oksygen til fullstendig forbrenning
Organisk kjemi
Organisk kjemi omhandler karbonets evne til å lage lange kjeder med kovalente bånd mellom karbontomene, og karbonets evne til å binde andre atomer spesielt hydrogen (H), oksygen (O), nitrogen (N) og svovel (S). Disse kan samles i funksjonelle strukturgrupper som alkohol-, karboksylsyre-, eller karboksyl-gruppe. Karbonkjedene kan være greinete eller rette. Syklopropan, syklobutan, syklopentan, sykloheksan er eksempler på heterosykliske karbonringer. Hvis ringene inneholder andre atomer i tillegg til karbon kan det dannes pyrrol (nitrogen) eller piperidin (nitrogen).
Alkaner er rene hydrokarboner som består av bare karbon og hydrogen. Hydrokarboner er uløselige i vann, og i en oksygenatmosfære kan de forbrennes fullstendig til karbondioksid og vann. Alkaner er mettede organiske forbindelser, men stoffer med karbon-karbon dobbelt- eller trippelbindinger kalles umettet. Alle alkaner i kjeder har strukturformel CnH2n+2 hvor n er antall karbonatomer. I biologisk sammenheng er metan og etan viktigst. Hydrokarboner med en eller flere dobbeltbindinger kalles alkener (olefiner er et gammelt navn på alkener), og med karbon-karbon trippelbindinger kalles de alkyner.
Aromatiske hydrokarboner inneholder en eller flere benzenringer med 6 karbonatomer med alternerende dobbeltbindinger . Alkoholer har festet hydroksylgrupper til karbonatomet med struktur ROH hvor R er resten av molekylet, f.eks. metanol og etanol. I alkoholer hvor karbonet som binder hydroksylgruppen også inneholder ett eller flere hydrogen så kan hydrogen med tilhørende elektroner (H:-) avgis til en akseptor i en oksidasjon. Når et alkohol (RCH2OH) oksideres dannes det først et aldehyd (RCH=O), og deretter en karboksylsyre (RCOOH) ved videre oksidasjon. Aldehyd oksideres lettere enn alkohol. Stoffer som har en karbon-oksygen dobbeltbinding (C=O) kalles karbonylgruppe. Hvis det er et hydrogen i tillegg til karbonylgruppen kalles det et aldehyd. Hvis det er festet to hydrokarboner til karbonyl er det et keton. Hvis det er festet en hydroksylgruppe til karbonet i en karbonylgruppe dannes en karboksylsyre. Etere er to alkyler festet sammen med et oksygen.
Estere er en binding mellom en karboksylsyre og et alkohol, og estere gir lukt og aroma fra planter. Kutin i kutikula og suberin er en polyester av hydroksyfettsyrer. Karboksylsyrer kan omdannes til amider (-(C=O)NH2, -(C=O)NH-R) og hydroksyl i karboksylgruppen erstattes med en nitrogen. Aminer er produkter fra ammoniakk (NH3) hvor en eller flere av hydrogenatomene er erstattet med hydrokarboner.
Makromolekyler er satt sammen av (polymerisert) av et stort antall mindre byggesteiner (monomere). Polypropylen (CH3CH=CH2 )n , og polyetylen ( CH2CH2)n (kjeden kan også være greinet) er eksempler på syntetiske polymerer. Polyetylen er laget ved å sette sammen tusenvis av etylenmolekyler i en lang kjede. Kjedene folder og krøller seg tilfeldig, som en kjele med spaghetti. Polymerer danner mange typer plast.
Kevlar er en polymer laget av firmaet DuPont hvor kjedene ligger strukturert på linje i en semikrystallinsk form. Kevlar blir brukt i skuddsikre vester. Spectra er en lettere utgave av en slik polymer og brukes bl.a. i hansker hvor man ikke skal kutte seg. Polyestere og polyamider har i tillegg andre funksjonelle grupper. Teflon er et polymer av -(CF2-CF2)n-. Nylon er et polyamid. Polystyren som brukes til isolasjon er en polymer av styren (C6H5- CH=CH2)n. Polyvinklorid (PVC) er en polymer av (CH2=CHCl)n. Dacron er en polyester som ikke angripes av sopp på samme måte som bomull og kan brukes til materiale som ofte er fuktig f.eks. seil på en seilbåt. Mylar er en tilsvarendepolymer som brukes til kassettbånd. Polyakrylater er polymere av akrylsyre (CH2=CHCOOH).Metyl-alfa-cyanoakrylat kan polymerisere og brukes i superlim.Nylon er en polymer av diaminer og dikarboksylsyrer. Gummi er elastisk og kan skifte form når den strekkes. Gummi er bygget opp av isopren (2-metyl-1,3-butadien). Alkengruppene i gummi kan angripes av oksidanter som ozon, og det må tilsettes antioksidanter for å hindre at gummien eldes og sprekker. Butylgummi er en kopolymer av isopren og 2-metylpropen.
Organiske molekyler finnes ofte som stereoisomere, stoffer som har samme molekylformel, men forskjellige tredimensjonal romlig orientering av atomene i molekylet. Stereoisomere er speilbilder av hverandre og er kirale. Kirale isomere kan være optiske isomere. To speilbilder kalles enantiomere. Optiske isomere har lik indre oppbygning. Den magnetiske og elektriske vektoren til lys ligger normalt på hverandre. Lys kan polariseres ved å passere et polaroidfilter hvor lys som passerer vibrerer bare i ett plan. Upolarisert lys vibrerer i alle plan. Kirale stoffer roterer planpolarisert lys enten til høyre eller venstre. Cis-isomere er stereoisomere med to kjemiske grupper på samme side av et plan, de har ligander nær hverandre på samme side, mens trans-isomere har dem på motsatt sider av hverandre.
Glass
Kvartssand, silisiumdioksid (SiO2) danner grunnlaget for glass, som er en amorf fast fase. Kvartssand smelter ved 1700 oC, men hvis sanden blir blandet med natriumkarbonat (Na2CO3) smelter den ved ca. 750 oC. Hvis kalsiumkarbonat (CaCO3) tilføres sammen med natriumkarbonat dannes det sodaglass, kjent fra det gamle Egypt. Den høye temperaturen gjør at kalsiumkarbonat spaltes til kalsiumoksid (CaO) og karbondioksid (CO2), og natriumkarbonat spaltes til Na2O og karbondioksid. Glasset må holdes varmt i en periode etter at det er laget for å kvitte seg med spenninger i glasset. Kalsiumkarbonat kan erstattes med magnesiumkarbonat og aluminiumoksid. Kvarts inneholder noe jern, og dette gjør at glasset farges grønt, den billigste formen av glass. Hvis man tilfører små mengder av arsen, kobolt eller selen kan den grønne fargen forsvinne. Generelt vil transisjonsmetaller gi forskjellige farger på glass. Kobber eller kobolt gir blått glass. Kromforbindelser gir grønt glass. Rødfarget glass kommer fra kobberselenid (CuSe) eller kadmiumselenid. Skarpe kanter på soda-silikaglass blir avrundet i kanten ved oppvarming i bunsenbrenneren. Sodaglass utvider og trekker seg sammen ved temperaturendringer, og dette kan gi spenninger i glasset som gjør at det sprekker.
I borsilikatglass byttes noe av natriumkarbonat ut med boroksid (B2O3), og noe av kalsiumkarbonat erstattes med aluminiumoksid (Al2O3). Pyrex® er borsilikatglass. I krystallglass er natriumkarbonat erstattes med blyoksid (PbO), et glass med høy brytningsindeks. Når det kuttes og poleres får det mange skinnende flater, noe som gjør krystallglass attraktivt.
Det finnes mange typer sikkerhetsglass, bl.a. i frontruter på biler. For å hindre at det spruter glassbiter når glasset knuses kan det legges en plastfilm mellom to glasslag. Det laminert glasset holdes sammen av plastfilmen hvis det knuser. Mest vanlig sikkerhetsglass idag ved en spesiell varmebehandling av glasset. Hvis det knuser blir det masse biter, men som ikke sprer seg omkring.
Løsninger
Vann er universalløsningsmiddelet (solvent) i biologiske systemer.
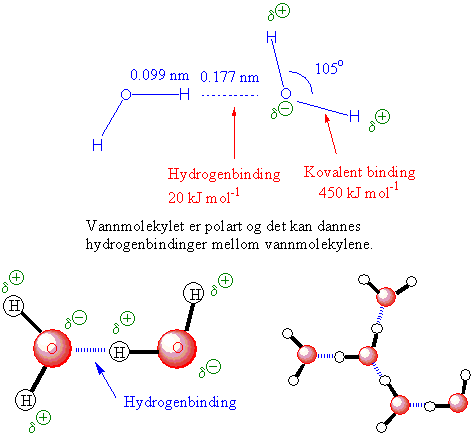
Oppløste stoffer (solute) har forskjellig løselighet. Vann og etanol er blandbare væsker, fordi etanol inneholder hydroksylgrupper som kan danne hydrogenbindinger med vannmolekylene. Likt løser likt. Løses ioner i vann legger det seg vannmolekyler rundt ionene og danner en vannkappe. Kolligative egenskaper til løsninger avhenger av populasjonen av partikler i løsningen og ikke av dere kjemiske egenskaper. Oppløste stoffer gir frysepunktdepresjon og kokepunktforhøyelse. Francois Marie Raoult (1830-1901) formulerte Raoults lov som bl.a. sier noe om vanndamptrykket over løsninger. Revers osmose brukes til å få drikkevann fra saltvann hvor det brukes membraner med celluloseacetat og trykk.Vannmolekylet er et polart molekyl med en negativ ladning ved oksygen og to positive ladninger ved hvert sitt hydrogen. Tiltrekning mellom vannmolekyler kalles dipol-dipol tiltrekninger og er mye svakere enn kovalente bindinger. Hydrogenbindingene er generelt mye sterkere enn andre dipol-dipol bindinger. På grunn av forskjellig elektronegativitet blir både O-H og N-H bindinger polare, og begge er vanlige i biologiske molekyler. Når vann fryser kan ikke vannmolekylene lenger bevege seg fritt omkring og molekylene må finne seg faste plasser. Tettheten er masse dividert på volum, og når volumet øker på den samme mengden masse så må tettheten minske og isen flyter derved på vannet. I molekyler uten noen fast dipol kan det oppstå midlertidige og momentane elektronforflytninger i et molekyl som induserer dipoltiltrekninger i nabomolekyler kalt London-krefter etter den tyske fysikeren Fritz London. Londonkreftene avhenger av størrelsen på elektronskyen og antall atomer i molekylet. Store elektronskyer gjør at de ytre elektronene blir lettere påvirkelig . Bremsevæske i en bil og hydrauliske maskiner baserer seg på at væsker ikke kan presses sammen, og brukes til å overføre krefter til å løfte eller bevege.
Overflatespenningen som er kontakten mellom væsken og dens egen gassfase eller luft gjør at væsken forsøker å få så lite overflateareal som mulig. Det minste overflatearealet for et gitt volum er kuleformen. Overflatespenningen gjør at det er mulig å fylle et glass med vann over kanten av glasset. Overflatespenningen virker tilsynelatende som en tynn "hud" omkring væsken. Skjenkes glasset for fullt blir gravitasjonskreftene for dominerende og det renner over. Det er forskjell i tiltrekninger mellom molekyler inne i væsken og ved overflaten av væsken. Molekyler inne i væsken blir tiltrukket jevnt i alle retninger, men molekylene ved overflaten tiltrekkes sterkere mot det indre av væsken. Et system blir mest stabilt når den potensielle energien er lavest. En av egenskapene ved vann er vannets evne til å fukte overflater. Bensin og parafin har lav overflatespenning og sprer seg lett utover en vannflate. Overflateaktive stoffer/detergenter.
Viskositet (dynamisk viskositet )skyldes intermolekyler tiltrekninger (dipol og Londonkrefter) og jo sterkere disse tiltrekningene er desto mer viskøst er materiale. Tørris er fast karbondioksid og den smelter ikke, men sublimerer og går direkte over til karbondioksid. Når en væske fordamper gir den avkjøling. Fordampning skjer fra hud eller lunger og gir avkjøling.