Ozon (O3) er et meget kraftig oksidasjonsmiddel med normalpotensial (Eo= 2.07 V) for redoks-paret O2 + H2O → O3 + 2 H+ + 2e- .
Ozon i stratosfæren absorberer stråling i området 200 - 300 nm og beskytter livet på jorda mot ultrafiolett stråling.
Troposfæreozon
Ozon finnes nær jordoverflaten som troposfæreozon i konsentrasjon 20-40 pbb, men konsentrasjonen kan øke under såkalte ozonepisoder. Ozon er et kraftig oksidasjonsmiddel som splitter karbon=karbon dobbeltbindinger. Kollisjoner mellom O-atomer og dioksygen på overflater til partikler kan gi opphav til ozon:
\(O\;+\;O_2\;+M\rightarrow O_3\;+\; M\)
hvor M er et hvilket som helst molekyl som kan absorbere kinetisk energi fra kollisjoner.
O-atomer kommer fra nitrogendioksid (NO2) som spaltes av sollys til nitrogenmonoksid (NO) og atomært oksygen (O).
\(\displaystyle NO_2 \;+\; h \nu \rightarrow NO\;+\;O\)
NO kan reagere med og nedbryte ozon i en naturlig ozonsyklus i atmosfæren:
\(\displaystyle NO\;+\;O_3 \rightarrow NO_2\;+\; O_2\)
Ozon er en viktig bestanddel i fotokjemisk smog i troposfæren, dannet i en lysavhengig reaksjon mellom flyktige hydrokarboner og nitrogenoksider som forstyrrer den naturlige ozonsyklusen. I nærvær av forurensninger i atmosfæren kan nitrogenmonoksid (NO) reagere med andre radikaler i stedet for ozon og vi får ozonepisoder. Ozondannelsen er størst ved høy lysfluks og temperatur og det er døgn- og årstidsvariasjoner i konsentrasjonen. Ozon i troposfæren har en naturlig bakgrunnsverdi opptil ca. 30 ppb. Ozon skiller seg fra andre luftforurensninger idet lave konsentrasjoner utover de naturlige bakgrunnsverdiene gir skader på planter, dyr og materialer. I naturen skjer det et naturlig utvalg av planter som tåler bakgrunnskonsentrasjonene med ozon.
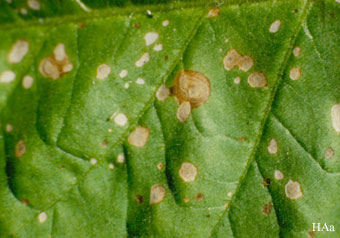
Bildet viser ozonskade på blad av ozonfølsom tobakk (Nicotiana tabacum) BelW3. Skadene ligner på hypersensitivitetsreaksjoner, og skyldes hydrogenperoksid (H2O2) dannet fra ozon og programmert kontrollert celledød. Hydrogenperoksid er viktig signalstoff i planter og samvirker med signalstoffet nitrogenmonoksid (NO) og den sekundære budbringeren kalsium (Ca2+). Hydrogenperoksid har flere funksjoner i plantene: deltar i plantenes immunforsvar, virker som signalstoff og deltar i åpning og lukking av spalteåpninger i spalteåpningsmekanismen. Vi forsøkte med egne eksperimenter å finne ut om ozon kunne gi opphav til hydroksylradikaler (OH•) i planter, undersøkt med spin-trapping og ESR i samarbeid med Fysisk institutt, UiO, , men klarte aldri å påvise dette.
Ozon kommer inn i bladene via spalteåpningene. Ozon eller ozonprodukter diffunderer via intercellularrom gjennom celleveggen til plasmamembranen. Lukkes spalteåpningene reduseres ozonopptaket. Når ozon gir lukking av spalteåpningene blir gassutvekslingen og fotosyntesen redusert, og biomasseproduksjonen reduseres. Hydrogenperoksid fra troposfæreozonepisoder kan også interferere med signalveier i planten og gi forstyrrelser av disse.

Ozonskade på blad fra tobakk BelW3. Skadene minner om tobakksmosaikkvirus som angriper tobakksblad, hvor sannsynligvis hydrogenperoksid også deltar.
Det er stor variasjon mellom og innen arter i deres evne til å tåle ozon. De eldre plantedelene er mer utsatt for skade enn de yngre. Skader av ozon som observeres på planter (avhengig av konsentrasjon) er:
- Lukking av stomata (spalteåpninger).
- Redusert fotosyntese og vekst.
- Redusert mengde og aktivitet av enzymet rubisko;
- Fremskyndet aldring
- Forvitring av kutikula og vokslag.
- Endringer i pigmentsammensetningen og permeabilitet i membraner.
- Økt syntese av etylen, polyaminer, antioksidanter, fri radikaler og fytoaleksiner.
- Redusert toleranse for frost og tørke.
- Minsket toleranse for soppangrep.
- Endring i mykorrhiza
- Økt eller minsket mørkerespirasjon og fotosyntese.
- Redusert fotorespirasjon og økt antall peroksisomer.
Ozon angriper kjemiske karbon-karbon dobbeltbindinger (C=C) i en Criegee-reaksjon, og produktene kan være hydrogenperoksid (H2O2), aldehyder, og peroksider.

Ozonskader på tobakk som viser at eldre blad (lengst til venstre) er mer følsom for ozon enn de yngre bladene, yngst lengst til høyre.
Alt levende liv i en aerob atmosfære utsettes for de skadelige virkningene av forskjellige former av oksygen, inkludert ozon. Oksidative skader på DNA, proteiner, fett, sukker eller andre makromolekyler har vært postulert som hovedårsaken til ødeleggelser som leder til aldring og aldringsrelaterte skader. Oksidativt stress oppstår når dannelsen av fri radikaler og andre prooksidanter overstiger forsvarssystemenes kapasitet. Det er kjent at flere typer stresspåvirkning som tørke, frost, luftforurensninger, aldring, insekts- og soppangrep, UV- og radioaktiv stråling fører til dannelse av radikaler plantene. Et radikal er et stoff med et uparet elektron (odde antall elektroner).
Ozon dannes fra oksygen ved UV-absorbsjon eller ved elektriske utladninger (lysbue). Konsentrasjonen av ozon kan måles som UV-absorbsjon.

En ozongenerator fra Biologisk institutt, UiO, hvor oksygen (O2) fra en gassflaske sendes inn i generatoren. Fra et ozonprosjekt "Effekter av ozon på vegetasjon", HAa, TVLF 1985-1996.

Mengden ozon målt i en fotometrisk ozonanalysator.
Stratosfæreozon
Stratosfæren er en del av rommet rundt jordkloden fra 10-50 kilometer. Ozonlaget i stratosfæren beskytter Jorden mot skadelig ultrafiolett stråling, og opptil 99% av Solas UV-stråling tas opp av ozon-oksygensyklus. Fotodissosiasjon av oksygen med ultrafiolett lys gir to oksygenatomer og virker som en skjerm mot UV-stråling. For å få fotodissosiasjon av molekylært oksygen til atomært oksygen trengs fotoner med minst 5.1 eV dvs. lys med kortere bølgelengde enn 240 nanometer (nm). Mest effektive i dannelse av ozon er bølgelengder fra 176 - 200 nm. I kommersielle instrumenter som brukes til å lage ozon brukes kvikksølv (Hg)-linjen ved 185 nm eller via en elektrisk lysbue. Atomært oksygen reagerer med molekylært oksygen og danner ozon. Ozon lages i Jordens øvre atmosfære. Nettomengden med ozon i stratosfæren varier med årstid og breddegrad. Ved høyde 25 km og atmosfæretrykk er ikke laget tykkere enn 2.5 mm. Det er tynnest over ekvator og varierer i tykkelse avhengig av solstrålingsfluks og solaktivitet. I tropiske strøk er tykkelsen på ozonlaget ca. 240 DU (DU- Dobson-enheter). 100 DU tilsvarer et 1 mm tykt lag ved standard trykk og temperatur (STP). Mengden ozon måles i Dobson-enheter etter Gordon Dobson, og tilsvarer 2.7·1016 molekyler med ozon i en 1 cm2 søyle fra jordoverflaten til gjennom stratosfæren. 200-400 Dobson-enheter vil si et 2-4 mm tykt ozonlag hvis det var ved havnivå. Normalt for atmosfæren er 350-450 DU. En Dobson-enhet er tykkelsen ozon vil innta hvis den ble samlet sammen i en tynn hinne som dekker jorda ved atmosfæretrykk og er 10 μm tykk.
Ozon kan dekomponeres til molekylært oksygen av atomært klor og nitrogenoksider. Ozon kan også brytes ned at polare stratosfæreskyer. Ozon er et effektiv UV-filter og absorberer omtrent all stråling under bølgelengde 280 nanometer (nm). Syklusen starter med at UV-lys med bølgelengde mindre enn 242 nm spalter dioksygen (O2) til atomært eksitert oksygen O*.
\(O_2 \;+\; UV\;\left(\lambda < 242\; nm\right) \rightarrow O^*\)
Når eksitert atomært oksygen kolliderer med molekyler med dioksygen dannes ozon (O3) hvor overskuddsenergien havner i et molekyl med nitrogen eller oksygen kalt M.
\(O_2\;+\;O^*\;+\; M\;\rightarrow \; O_3 \; +\; M\; + \; varme\)
Det er viktig at overskuddsenergien blir fjernet ellers ville ozonmolekylet bli spaltet straks etter at det var blitt dannet. Nå kan imidlertid ozonmolekylet absorbere UV og bli omdannet til oksygen og atomært eksitert oksygen.
\(O_3 \;+\; UV\;\left(\lambda\;i\; området\; 240-320\; nm\right) \rightarrow \; O_2 \;+ O^*\)
Atomært eksitert oksygen i siste trinn brukes i reaksjonen foran og lager en kjedereaksjon. Energien til UV blir fjernet som varme.
Klorfluorkarboner (KFK, freoner) og lystgass (N2O) påvirker ozon-oksygensyklus. Ozonlaget er utsatt for nedbrytning bl.a. vil kloratomer dannes i reaksjon med KFK og UV. Atomært klor (Cl) kan reagere med O*, og kloratomer kommer fra klorofluorokarboner (freoner) fra kjøleanlegg f.eks. CCl3F eller CCl2F2 .
\(CCl_2F_2\;+\; UV \rightarrow \; CClF_2\;+\; Cl\)
Atomært klor (Cl) ødelegger ozon ved å ødelegge ozonsyklus:
\(Cl\;+\; O_3 \rightarrow \; ClO\;+\; O_2\)
ClO kan reagere med et oksygenatom laget i normal O2/O3 syklus og gi et nytt radikal:
\(ClO\;+\; O \rightarrow Cl\;+\; O_2\)
\(ClO\;+\; ClO \rightarrow \; Cl_2O_2 \rightarrow Cl_2\; \left(fotodissosieres \right)\;+\; O_2\)
Målinger fra 1970 tallet viste at det ble dannet et ozonhull i Antarktis med redusert tykkelse av ozonlaget, lavest i oktober og det blir gjenopprettet i perioden fra november til mars. Gjennom den antarktiske vinter synker temperaturen i stratosfæren til -78 oC og det dannes tynne polare stratosfæreskyer med iskrystaller og reaksjonsprodukter mellom nitrogendioksid (NO2) og vann. Molekylært klor fester seg til skyene, og klor blir dannet i reaksjonen: Nettoreaksjonen er ødeleggelse av betydelige mengder ozon. Polare stratosfæreskyer, skyer av salpetersyre- (HNO3-3H2O) og svovelsyreis antas å delta i prosessen ved Antarktis. F.eks.
\(HCl \;+\; ClONO_2 \rightarrow Cl_2\;+\; HNO_3\)
Saltsyre (HCl) dannes når atomært klor reagerer med metan, som også er en drivhusgass, og danner CH3 og HCl.
\(ClO\;+\; NO_2 \rightarrow ClONO_2\)
I tillegg finnes det brom i stratosfæren som også kan innvirke.
Når våren kommer til Antarktis frigis store mengder klor fra stratosfæreskyene og klor (Cl2) omdannes til atomært klor (Cl) som bryter ned ozon. I oktober 1994 sank ozonmengden til 100 dobson.Seinere på året overfører vinder ozon til Antarktis. Crutzen, Molina og Rowland fikk nobelprisen i kjemi i 1995 for sitt arbeid med kjemien til freoner og stratosfæreozon
Ozonskade på blad fra ozonfølsom tobakk BelW3.
Ozon reagerer med karbon-karbon dobbeltbindingerLitteratur:
Wikipedia