Plantene tar opp jern fra jernoksider i jorda. De fleste organismene i en oksygenatmosfære har vanskeligheter med å ta opp jern, og inneholder derfor en eller flere typer jernbærere (sideroforer). Jern heter ferrum på latin Mangelsymptomene viser seg som anemi hos mennesker og klorose hos planter. Satt litt på spissen kan man si at den organismen som behersker jernreservoaret i et økosystem vil være den dominerende organismen. Jern er et transisjonsmetall, endrer lett oksidasjonsnivå og er derfor en viktig elektrontransportør i redoksreaksjoner i biologiske systemer. Jern i ioneform finnes som en redusert form Fe2+ (ferro, Fe(II)) eller en oksidert form Fe3+(ferri, Fe(III)). I vann oksideres Fe2+ til Fe3+ lettere jo mindre sur løsningen er. Mesteparten av jern finnes bundet til hem og cytokromer. Ferrochelatase er enzymet som plasserer Fe2+ i tetrapyrollringen i porfyrinringen som brukes til å lage cytokromer. Jern finnes også bundet til cysteinsvovel som Fe2S2 i proteiner. Cytokromer og jern-svovelproteiner er viktige i redoksystemene i kloroplaster og mitokondrier.
Den lave konsentrasjonen av jern i en oksygenatmosfære skyldes det lave oppløselighetsproduktet for treverdig jern.Under aerobe forhold blir det ofte jernmangel fordi ferrijern (Fe3+) danner uløselige jernoksider (Fe2O3·3H2O) og dette gjelder spesielt ved nøytral og basisk pH. Under anaerobe forhold finnes jern som ferrojern (Fe2+), og det blir derfor rikelig jerntilgang, og det kan ofte bli så mye at det blir giftig. Planter som har røtter i anaerob jord i sump og vannsyk jord har aerenkym som bringer oksygen ned til røttene og hvor toverdig jern kan oksideres til treverdig som legger seg utenpå røttene. Derved unngås giftvirkningen av toverdig jern. Under aerobe forhold kan plantene lette jernopptaket ved å gjøre rotsonen mer sur ved å skille ut protoner (H+) eller ved å redusere treverdig til toverdig jern i rotsonen (rhizosfæren). Noen gener for H+-ATPase blir indusert av jernmangel.
Jern finnes i enzymene nitrat reduktase, nitrogenase, akonitase, ACC-oksidase, katalase, jern-superoksid dismutase (Fe-SOD), lipoksygenase og peroksidase. Leghemoglobin, som brukes til å regulere oksygenkonsentrasjonen ved nitrogenfiksering i erteplanter, inneholder også jern. Jern trengs for å lage klorofyll. Jernmangel har mindre effekt på bladvekst og celleantall, men har stor effekt på størrelsen av kloroplaster og innholdet av kloroplastprotein.
Lavere pH og forsuring øker tilgjengeligheten av jern i betydelig grad. Treverdig jern kan reduseres til toverdig på plasmamembranen katalysert av Fe(III) reduktase eller Fe(III)chelat reduktase. Jern kan også reduseres ekstracellulart ved hjelp av nikotinamid adenin dinukleotidfosfat i redusert form (NADPH). Chelater danner løselige komplekser med kationer (Fe2+, Fe3+, Ca2+) bundet med ionekrefter som f.eks. jern i chelatene Fe-citrat eller Fe-tartrat. Inne i planten finnes jern bundet til chelater bl.a. sitronsyre. I næringsløsninger og vannløselig handelsgjødsel kompleksbindes jern i et Fe-EDTA-chelat (EDTA-etylendiamin tetraeddiksyre) eller Fe-DTPA (DTPA-dietylentriaminpentaeddiksyre, pentensyre).
Ferritin
Jern lagres i frø og røtter bundet til proteinet ferritin (fytoferritin), som også deltar i lagring av overskudd av jern i ikke-grønne plastider. Det er viktig å opprettholde jern homeostase og jern kan bli fraktet inn i ferritin. Fe(II) mottar et elektron, blir oksidert til Fe(III) og denne formen av jern pakkes tett sammen i en kjerne og som omgis med proteiner som danner et skall. Fytoferritin har et kuleformet proteinskall med 24 like subenheter, og inne i kula er det 5400-6200 Fe bundet som jernoksid-fosfatkompleks.
Sideroforer (jernbærere)
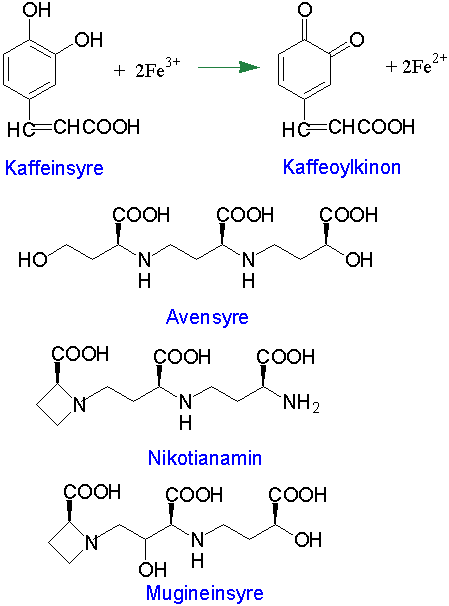
Plantene benytter flere mekanismer for å øke løseligheten og tilgjengeligheten av jern til røttene. Plantene kan respondere på jernmangel ved å lage sideroforer eller ved å senke pH i rotsonen. Bakterier kan skille ut sideroforer som inneholder hydroksamater (-CONOH), bl.a. i form av sykliske peptider, som binder jern meget sterkt. Sideroforene plukkes deretter opp av bakteriene, jern blir redusert fra treverdig til toverdig jern som løsner fra sidereforen, og deretter skilles sideroforen ut igjen for å ta opp mer jern. Mennesker bruker sideroforen transferrin i blod og laktoferrin i morsmelk og tårer. Plantene kan også skille ut lavmolekylære jernbærere (sideroforer, fytosideroforer) som binder til seg jern og planten kan ta opp sideroforer med bundet jern og frigjøre jernet i planten. Fenoler, fenolsyrer, organiske syrer og hydroksamater kan fungere som sideroforer. F.eks. komplekser Fe-sitronsyre og Fe-eplesyre (malat), Alle planter kan lage nikotianamin fra tre molekyler S-adenosylmetionin katalysert av nikotianamin syntase. Nikotianamin kan chelatere jern og zink (Zn2+) internt i planten, men skilles ikke ut av røttene. Avensyre og muginsyre er eksempler på fytosideroforer i grasfamilien, og som lages fra S-adenosylmethionin via nikotianamin
Hos mennesker blir jern fraktet i blodet med proteinet transferrin, og blir tatt opp av cellene via en transferrinreseptor og endocytose. Overskudd av jern som ikke blir brukt til å lage hem, cytokromer og jern-svovelproteiner blir lagret som ferritin.
I hvilken grad planterøttene kan utnytte bakterielle siderforer, sykliske hydroksamatpeptider, er ukjent. Jern kan ikke forflyttes internt i planten og jernmangel vises på de yngste bladene i form av klorose mellom ledningsstrengene.
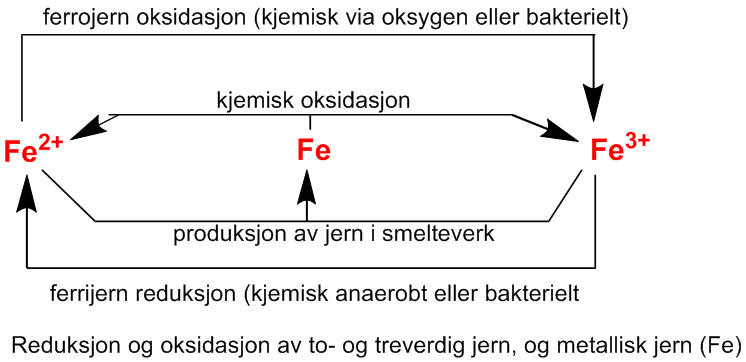
Vann fra oksygenfattig oversvømt jord, myr eller sediment er rik på toverdig ferrojern (Fe2+) og jernet i vann som kommer ut fra slike områder blir raskt oksidert til treverdig ferrijern (Fe3+) og felles deretter ut som rustrøde avleiringer:
![]()
Dette blir en surgjørende prosess idet det tas opp hydroksylioner.
![]()
Plantene må ha kontroll med opptak og lagring av jern, siden fritt jern kan inngå i Haber-Weiss-reaksjoner og gi opphav til oksygenradikaler. Jern fraktes i form av chelater f.eks. citrat (sitronsyre), nikotianamin, eller som muginsyre-chelater i grasfamilien.
Jern i jord
Jern i jord i en oksygenatmosfære inneholder jern i oksidert form, ferrijern (Fe3+). Jern finnes i et gitter i mange mineraler og i hematitt (Fe2O3)(gr. haima – blod, blodstein, rødjernstein, jernglans, jernglimmer), eller goethitt t(α-FeOOH) og lepidokrokitt (γ-FeOOH) fra oksidasjon av jernmineraler. Jern i myrmalm (FeO(OH)n ·H2O, limonitt, brunjernstein) er blitt brukt til jernutvinning. Jernoksider er lite løselige i alkalisk miljø, og kan også danne tungtløselig ferrifosfat, jernhydroksider og jernkarbonater.

Jernutfelling fra myrområde i høyfjellet. Hardangervidda.
Jernmalm kan redusert til jern ved høy temperatur sammen med karbon (trekull).
2Fe2O3 + 3C → 4Fe + 3CO2
Jernoksid redusert avgir oksygen, karbon blir oksidert og mottar oksygen.

Jernslagg fra Bærums Verk, Norges første jernverk fra 1622-1874

Jernnodul, Aurskog-Høland.

Jern(II)klorid (FeCl2·4H2O). Jernsalter har brun farge.
Ferrijern (III) i reaksjon med vann som hydratiseringsskall gir sur reaksjon:
[Fe(H2O)6]3+ + H2O → [Fe(H2O)5]OH2+ + H3O+
Opptak av jern i planterøtter
Den fysiologiske aktive formen av jern er ferrojern (Fe2+) i hem og jern-svovelproteiner. En ferrochelatase katalyserer innseting av jern i porfyrinringen og danner hem. Jern trengs i større mengder i plantene enn de andre mikronæringsstoffene. Planterøttene tar opp jern som toverdig ferrojern (Fe2+). I jord med oksygen finnes jern vanligvis som ferrijern (Fe3+) og blir bli tatt opp via et Fe3+-chelat i apoplasten. og redusert til Fe2+ på utsiden av plasmamembranen. Denne reaksjonen er katalysert av ferri chelat reduktase på plasmamembranen i rhizodermis (epidermis på røttene). Fe2+ blir tatt opp i cellen via Fe(II) transportører, og på innsiden med Fe2+ på nytt bli chelatert (Fe-nikotinamid, Fe-organiske syrer) for å unngå at fritt jern inngår i Fenton-reaksjoner og Haber-Weiss-reaksjoner med tilhørende produksjon av oksygenradikaler og andre reaktive oksygenforbindelser. Mange forsøk med planterøtter er gjort uten mykorrhiza, og det er rimelig å anta at mykorhiza påvirker opptaket av jern. Røttene kan ha økt overflateareal og volum via mange rothår med rhizodermale overføringsceller hvor plasmamembranen har labyrintiske utvekster og foldinger. Konsentrasjonen av jern øker i surt miljø og røttene kan skille ut protoner via protonpumpen H+ATPase.
Planterøttene kan skille ut fenoler og organiske syrer (sitronsyre (citrat) og eplesyre (malat) som chelaterer treverdig jern. I tillegg kan humussyrer og fulvinsyre fra mikrobiell nedbrytning av humus fungere som chelater. Humussyrer eer en bladning av mange forskjellige syrer med karboksy- og fenol-grupper. Fulvinsyrer er humussyrer, men lavere molekylvekt og mer oksidert. Humin er humusstoffer som er uløselig i vann.
Røtter hos gras skiller ut fytosideroforer i form av ikke-protein aminosyrer som danner løselige jernkomplekser, Fe(III) siderofor kompleks. Eksempler på slike trikarboksylsyrer laget fra tre molekyler S-adenosylmethionin er avensyre fra røttene til havre (Avena sativa), nikotianamin og mugineinsyre. Sopp og bakterier lager også sideroforer, men ofte i form av peptid-hydroksamater.
Høy konsentrasjon av fosfat kan gi ytfelling av fytoferritin. Fytoferritin er et kuleformet hult protein som kan lagre opptil 5000 Fe3+ som jernfosfat [FeO(OH)]8[FeO(H2PO4)].
Anerob oversvømt jord med ferrojern (Fe2+)
I anaerob jord finnes jern som ferrojern (Fe2+) og grunnet det høyere oppløselighetsproduktet for toverdig jern sammenlignet med treverdig gjør at jern kan komme opp i toksiske konsentrasjoner. En beskyttelsesmekanisme er at sumpplantene har aerenkym som bringer oksygen ned til røttene og det toverdige jernet blir oksidert til treverdig som legger seg som gir brunfargete utfellinger på røttene.
Jern i klorofyllsyntese
I biosyntesen av klorofyll er det enzymet klorofyllid a oksygenase som overfører klorofyll a til klorofyll b, og enzymet inneholder Rieske Fe-S-klynger et et Fe-senter. Overgangen fra Mg-protoporfyrin monometylester til divinyl protoklorofyllid katalysert av Mg protoporfyrin monmetylester syklase er et enzym med ikke-hem jern i en karboksylatbro-2Fe.
Sirohem som benyttes som kofaktor i nitrat reduktase og sulfitt reduktase blir laget av et 4Fe-4S sirohydroklor ferrochelatase, mens ferrochelatase som chelaterer jern inn i protoporfyrin IX inneholder ikke jern, bortsett fra i gjær.
Jern i fotosyntese
Fotosyntesen er avhengig av jern i selve strukturen og frakting av elektroner, men også i syntesen av porfyrin som brukes til å lage klorofyll og hem, som har en felles protoporfyrin IX forkomponent. I fotosystem II i thylakoidmembranene i kloroplastene er det i hvert reaksjonssenter to hem jernatomer og ett ikke-hem jern koordinert til fire histidin og bikarbonat, samt ett jern-hem atom bundet til cytokrom b559. Cytokrom b6f inneholder seks jernatomer, fire hem jern og to ikke-hem jern i 2Fe-2S Riske protein. I fotosystem I er det tre klynger med 4Fe-4S, i alt tolv jernatomer, og 2Fe-2S i ferredoksin som frakter elektroner til ferredoksin NADP+ reduktase.
Jernmangelsymptomer
Jernmangel gir klorose i de yngste delene av planten. Jermangel gir redusert biosyntese av porfyriner. Jern inngår i hem i proteiner som i cytokromer. Enzymet Mg-protoporfyring IX-monometylester er en syklase som lager isopentanonringen i klorofyll. Dette er en monooksygenase som trenger cytokrom P450 som kofaktor, og aktiviteten blir lav ved jernmangel. I tillegg inngår jern som elektrontransportør i elektrontransportkjeden i fotosyntesen. Peroksidase inneholder jern. Mangel på jern i enzymer som omsetter reaktive oksygenforbindelser gir økt fotodynamisk oksidasjon av klorofyll. Redusert biosyntese av klorofyll, samtidig med økt oksidasjon og destruksjon av klorofyll gir klorose. Mindre mengder klorofyll gir mindre behov for klorofyllbindende proteiner og derved lavere proteininnhold i kloroplastene.
Hos mennesker gir jernmangel anemi og de røde blodlegemene (erytrocytter) får redusert kapasitet til å frakte oksygen. For mye jern kan gi opphopning av jern i lever og gi hemokromatose.
Jern og fotosyntese i havet
Det er blitt utført mesoskalaforsøk med gjødsling av havet med jern for å øke fotosyntesen. Generelt har havvann høy pH og mesteparten av CO2 foreligger derfor som bikarbonat (HCO3-, hydrogenkarbonat). Den høye pH gjør at jern blir vanskelig tilgjengelig.
Boyd P V et al. Mesoscale iron enrichment experiments 1993-2005: Synthesis and future directions. Science 315, 2007, 612-617.
Korrosjon (rust)
Jern vil ikke korrodere (ruste) hvis det er koblet til en ytre spenningskilde. Hvis jern er koblet til magnesiummetall i en ytre krets vil magnesium (Mg2+ ) bli anode og Mg2+ vil gå i løsning, en såkalt offeranode. Jernet blir da katode og beskyttes av elektronene som gis til jern fra magnesium elektroden (anoden). Dette kalles katodebeskyttelse og hindrer korrosjon. Det samme skjer hvis jern er dekket av zink (Zn) ved galvanisering. Zn virker da som offeranode og løses opp, men jernet beskyttes katodisk (katodebeskyttelse).
Mg | Mg2+ || Fe2+ | Fe \(\Delta E= 1.91 V\)
Fe | Fe2+ || Fe2+ | Cu \(\Delta E = 0.78 V\)
Hvis imidlertid kobber (Cu) kobles til jern (Fe) blir kobber (Cu) katode og jern (Fe) anode og korrosjonen av jern øker. Hvis vann som renner gjennom jernrør inneholder Cu2+, og Cu2+ setter seg på overflaten, vil det virke som et lokalt batteri og gi økt korrosjon.
Korrosjon av jern i vann: Jernet frakter elektroner mellom den lokale anode og katode. Ferrojern (Fe2+) oksideres deretter til ferrijern (Fe3+) av oksygen.
Fe ⇔ Fe2+ + 2e- Oksidasjon (anode)
O2 + 4H+ + 4e- ⇔ 2H2O Reduksjon (katode)
2H+ + 2e- ⇔ H2
«Grønt stål»
Karbon (C), eller karbonmonoksid (CO) blir brukt til å redusere jern i hematitt i produksjon av stål. Smelteverksindustrien for stål blir derved en stor utslippskilde for CO2 som bidrar til økt CO2-konsentrasjon i atmosfæren som påvirker klima i negativ retning. . Det blir arbeidet med utvikling av «grønt stål» hvor man i stedet bruker gassen hydrogen (H2) i reduksjonen av hematitt. Reduksjon vil si å motta elektroner og avgi oksygen. Oksygen blir fjernet fra hematitt (Fe2O3) ved reduksjon og gir råjern. I neste transformeringstrinnet blir råjern legert avhengig av type stål med med krom, nikkel, mangan eller molybden. Deretter følger flere trinn med oppvarming og avkjøling.
Reduksjon av hematitt (Fe2O3) til jern (Fe) med karbon (C):
2Fe2O3 + 3C → 4Fe + 3CO2
Fe2O3 + 3CO → 2Fe + 3CO2
2C + O2 → 2CO
I en en blesterovn ca. 2000oC blir brukt til å utvinne jern hvor jernmalm, i eldre tider myrmalm i jernvinna. Jernmalm, koks (karbon) og kalkstein møter en blest (blåst) med varm luft og som gir råjern med høyt innhold av karbon.Høyt innehold av karbon gjør jernet sprøtt. Tilførsel av oksygen i en ovn fjerner karbon som CO2.
Alternativ til karbon i reduksjonen
Naturgass i form av metan blir omdannet til syngas bestående av en blanding av H2 og CO. Jernmalmpellets blir deretter redusert til jern
Fe2O3 + 2H2 → 2Fe + 3H2O (endoterm)
Fe2O3 + 3CO → 2Fe + 3CO2 (eksoterm)
Elektrolyse med tilførsel av elektroner (e-):
Katode: Fe2O3 + 12e- → 3Fe + 6O2-
Anode: 6O2- → 3O2 + 12e-
Lavtemperatur elektrolyse
Anode:12OH- →12 e- + 3O2 + 6H2O
Katode: 2Fe2O3 + 6H2O + 12e- →4Fe + 12OH-
Cortenstål
Cortenstål stållegering gir en rustaktig overflate etter å bli utsatt for all slags vær. Cortennstål er korrosjonsresistent og en oksidering av overflaten gir et beskyttende lag med rust og får en karakteristisk rustbrun overflate. Cortenstål inneholder karbon (C), silisium (Si), mangan (Mn), fosfor (P), svovel (S), krom (Cr), kobber (Cu), nikkel (Ni) og noen ganger vanadium (V). Cortenstål er et registrert varemerke ® for denne ståltypen fra US Steel som ble konstruert for å eliminere overflatebehandling med maling. I bruken må man ta hensyn til sveiseskjøter, og områder med spesielt mye nedbør og fuktig luft.
Natur og kultur
Jernnettene (nor. hjarn – frossen snø) var frykten for frost i tre på hverandre følgende frostnetter i august som kunne skade kornavlingene.
Litteratur
Wikipedia